
科目: 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ③④⑥⑦ | C. | ①②④⑥⑦ | D. | ①②⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一个D216O分子所含的中子数为8 | |
| B. | NH4Cl是只含非金属元素的共价化合物 | |
| C. | HCl的电子式为 | |
| D. | H2S不如HF稳定性强 |
查看答案和解析>>
科目: 来源: 题型:计算题
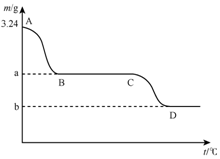 取3.24g碳酸氢钙在高温条件下分解,固体质量变化与温度的关系如图所示,试根据要求回答下列问题:
取3.24g碳酸氢钙在高温条件下分解,固体质量变化与温度的关系如图所示,试根据要求回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H+、Na+、NO3-、CO32- | B. | Fe3+、K+、I-、SCN | ||
| C. | Al3-、Cu2+、SO42-、NO3- | D. | NH4-、K+、Cl-、OH- |
查看答案和解析>>
科目: 来源: 题型:实验题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 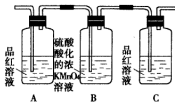 | 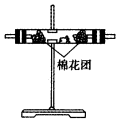 | 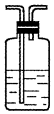 | 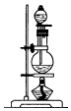 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com