
科目: 来源: 题型:选择题
| A. | 常温常压下,74g乙酸甲酯中含共用电子对数为11NA | |
| B. | 1mol Cl2通入足量的水中,转移电子数为NA | |
| C. | 足量的铁粉与200mL1 mol•L-1硝酸完全反应生成H2的分子败为0.1NA | |
| D. | 30g葡萄糖和乙酸的混合物中含碳原子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
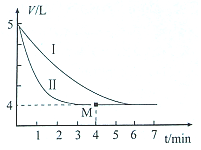
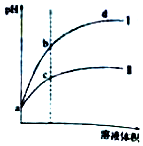 某温度下,体积相同、pH相同的盐酸和氯化铵溶液分别稀释.平衡时的pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
某温度下,体积相同、pH相同的盐酸和氯化铵溶液分别稀释.平衡时的pH随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | 曲线Ⅱ对应氯化铵溶液 | |
| B. | 与等浓度的NaOH溶液恰好反应时曲线Ⅰ对应的溶液消耗NaOH溶液体积大 | |
| C. | b点比c点水的电离程度大 | |
| D. | c、d两点的离子积常数不等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物数目不相同 | |
| B. | 乙烷,苯,葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 与环己醇(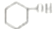 )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) |
查看答案和解析>>
科目: 来源: 题型:解答题
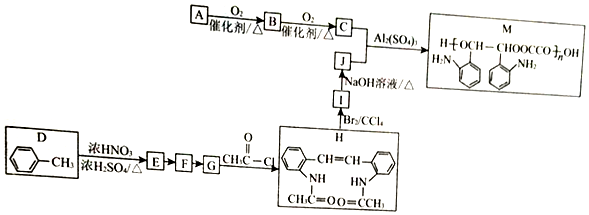
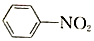 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$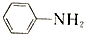 (-NH3容易被氧化)
(-NH3容易被氧化)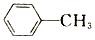 $\stackrel{NaClO}{→}$
$\stackrel{NaClO}{→}$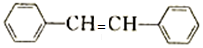
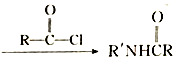 (R和R′代表烃基)
(R和R′代表烃基)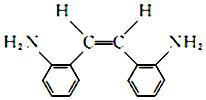 .
.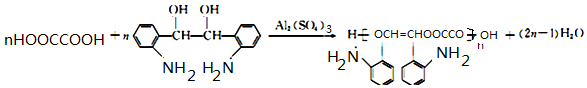 .
.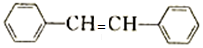
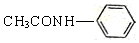 的合成路线
的合成路线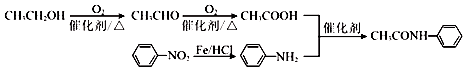 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①和②混合后,酸碱恰好中和,溶液呈中性 | |
| B. | ①和③中均有c(F-)+c(HF)=0.1mol/L | |
| C. | ①和③混合:c(F-)+c(OH-)=c(H+)+c(HF) | |
| D. | 由水电离出来的c(OH-):②>③>① |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若将lmol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA | |
| B. | lmolCH3COONa和少量CH3COOH溶于水所得中性溶液中,CH3COO-的数目为NA | |
| C. | 标准状态下,2.24LC12溶于水,转移的电子数目为0.1NA | |
| D. | 标准状况下,11.2L三氯甲烷所含的原子数为2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1
磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1查看答案和解析>>
科目: 来源: 题型:解答题
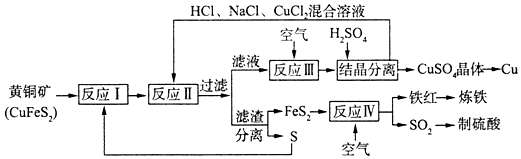
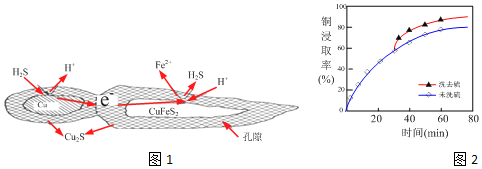
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子总数为NA的SO2和CO2的混合气体中含有的氧原子数为2NA | |
| B. | 0.1mol/L(NH4)2SO4溶液与0.2mol/LNH4Cl溶液中的NH4+数目相同 | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 1molNa与足量O2反应生成了混合物,Na失去NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com