
科目: 来源: 题型:选择题
| A. | 铅蓄电池充电时,阳极固体质量增大 | |
| B. | 0.1mol•L-1CH3COONa溶液加热后,溶液的pH减小 | |
| C. | 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023个 | |
| D. | 室温下,稀释0.1mol•L-1氨水c(H+).c(NH3•H2O)减小 |
查看答案和解析>>
科目: 来源: 题型:推断题
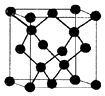 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.| 氢化物 | HxA-AHx | HmB-BHm | HnC-CHn |
| 键能(kJ.mol-1 | 346 | 247 | 207 |
查看答案和解析>>
科目: 来源: 题型:解答题
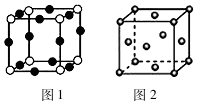 A、B、C、D、E是元素周期表中前36号元素,核电荷数依次增大,A与B能形成种类繁多的化合物,D原子中成对电子数等于未成对电子数的3倍;E+中所有电子正好充满K、L、M三个电子层.
A、B、C、D、E是元素周期表中前36号元素,核电荷数依次增大,A与B能形成种类繁多的化合物,D原子中成对电子数等于未成对电子数的3倍;E+中所有电子正好充满K、L、M三个电子层.查看答案和解析>>
科目: 来源: 题型:解答题
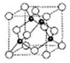 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.
前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.| 能级(I) | I1 | I2 | I3 | I4 | I5 |
| 电离能/kJ•mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:解答题
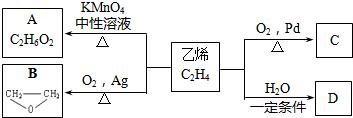
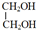 +2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.查看答案和解析>>
科目: 来源: 题型:选择题
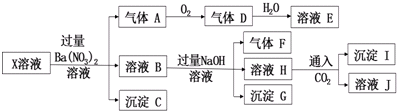
| A. | 气体A是无色有刺激性气味的有毒气体 | |
| B. | X中肯定存在Fe2+、Mg2+、NH4+、SO42- | |
| C. | 沉淀I中加入过量溶液E,沉淀完全溶解 | |
| D. | X中不能确定的阳离子只有A13+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.50mol•L-1 | B. | 0.75mol•L-1 | C. | 1.00mol•L-1 | D. | 3.18mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
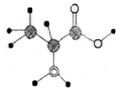 如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )
如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )| A. | 分子式为C3H7O2N | |
| B. | 该分子不能与碳酸钠发生反应 | |
| C. | 该分子可以与盐酸发生反应 | |
| D. | 该分子在一定条件下可以反应生成高分子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO(g)燃烧热△H=-283.0 kJ•mol-1,则反应2CO2(g)=2CO(g)+O2(g)的△H=2×283.0kJ•mol-1 | |
| B. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| C. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1,说明金刚石比石墨稳定 | |
| D. | 相同状况下,H2在Cl2中燃烧生成1molHCl和H2与Cl2光照爆炸生成1molHCl的反应热不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com