
科目: 来源: 题型:选择题
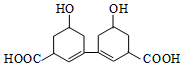 中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )| A. | 该物质的熔点比同碳的烃分子熔点高 | |
| B. | 分子式为C14H18O4 | |
| C. | 1mol该有机物与足量的金属钠反应产生4molH2 | |
| D. | 环上氢原子的一氯取代物5种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 100 g含氢元素质量分数为12%的乙烯和乙醛(C2H4O)的混合物中,所含氧原子数目NA | |
| C. | 实验室制氯气的化学方程式:KClO3+6H37Cl(浓)═KCl+337Cl2↑+3H2O | |
| D. | 2.0 L 0.5 mo1/L NaAlO2溶液中含有氧原子的数目为 2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
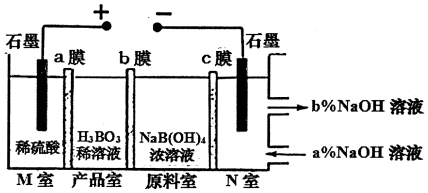
| A. | M室发生的电极反应式:2H2O-4e-═O2↑+4H+ | |
| B. | N室:a%<b% | |
| C. | 产品室发生的反应是:B(OH)4-+H+?H3BO3+H2O | |
| D. | 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
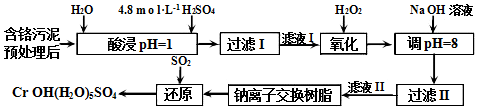
查看答案和解析>>
科目: 来源: 题型:解答题
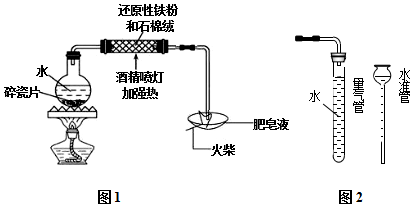
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若向Na2S溶液中通入SO2则产生淡黄色沉淀 | |
| B. | 这三种酸都是二元酸,都能与氢氧化钠反应生成酸式盐和正盐 | |
| C. | 这三种酸的水溶液久置空气中都会变质 | |
| D. | 向氢硫酸、亚硫酸溶液中滴加氯水都会发生氧化还原反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
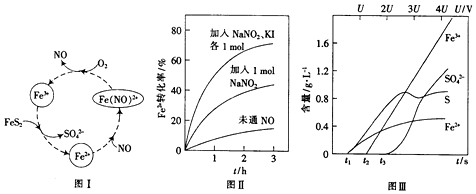
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 结论 |
| A | 相同条件下,分别测量0.1mol/L和0.01mol/L的醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
| B | 向Co2O3固体中滴加浓盐酸,有黄绿色气体生成 | 氧化性:Co2O3>Cl2 |
| C | 向淀粉溶液中滴加少量稀硫酸,水浴加热一段时间后冷却,向溶液中滴加碘水,溶液变蓝 | 淀粉未发生水解 |
| D | 常温下,分别测量浓度均为0.1mol/L的Na2S溶液和NaClO溶液的pH,前者的pH大 | 酸性:HClO>H2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
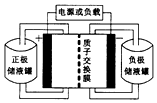 一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-下列说法正确的是( )
一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-下列说法正确的是( )| A. | VCl2存储在正极储液罐内 | |
| B. | 放电时H+从负极区移至正极区 | |
| C. | 充电时电池的负极与电源的正极相连 | |
| D. | 充电时阳极反应为Br-+2Cl--2e-═BrCl2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com