
科目: 来源: 题型:解答题
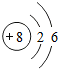 ,b的最简单氢化物的电子式为
,b的最简单氢化物的电子式为 .
.查看答案和解析>>
科目: 来源: 题型:实验题
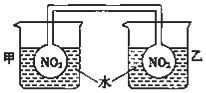 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:
航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:查看答案和解析>>
科目: 来源: 题型:选择题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含最/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
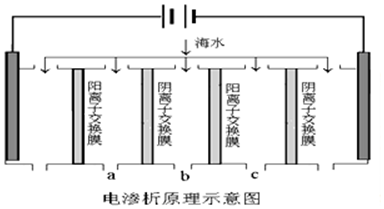
| A. | 电解一段时间后阴极区会发生反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 阳极的电极反应式为2H2O-4e-═O2↑+4H+ | |
| C. | 电解时b室中阴离子移向a室,阳离子移向c室 | |
| D. | 淡水的出口为b出口 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:B>A>C>D | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 四种元素一定都属于短周期元素 |
查看答案和解析>>
科目: 来源: 题型:解答题
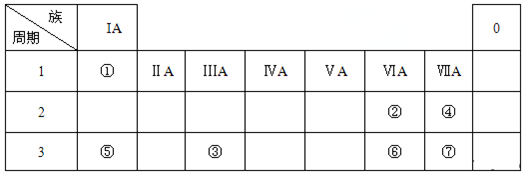
查看答案和解析>>
科目: 来源: 题型:推断题
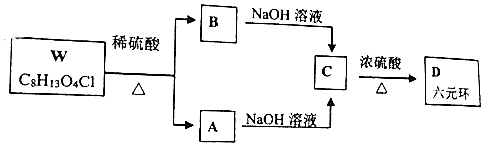
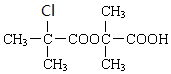 +H2O$→_{△}^{浓硫酸}$
+H2O$→_{△}^{浓硫酸}$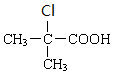 +
+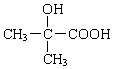 .
.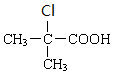 +2NaOH→
+2NaOH→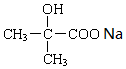 +2NaCl+H2O.
+2NaCl+H2O.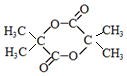 .
.查看答案和解析>>
科目: 来源: 题型:解答题
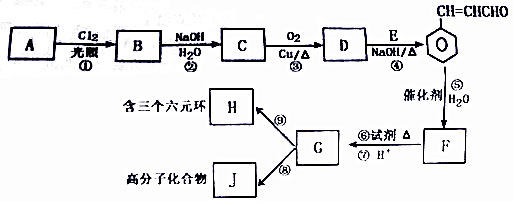
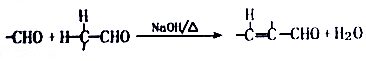
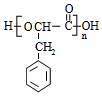 .
.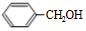 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2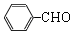 +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com