
科目: 来源: 题型:选择题

| A. | 400℃时,生成的产物有N2、NO、H2O | |
| B. | 800℃时,反应的化学方程式是:4NH3+5O2$\frac{\underline{\;Pt-Rh\;}}{800℃}$ 4NO+6H2O | |
| C. | 400℃-800℃间,Pt-Rh合金对N2的吸附力逐渐减弱 | |
| D. | 800℃以上,发生了反应:2NO(g)?O2(g)+N2(g)△H>0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | Z | 目的 | 装置 | |
| A | 甲苯 | KMnO4溶液 | 稀硫酸 | 证明甲基对苯环的性质存在影响 | 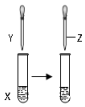 |
| B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 证明增大反应物浓度化学平衡向正反应方向移动 | |
| C | 1mol/LNaOH 溶液5mL | 1-氯丁烷5mL | 2%AgNO3 溶液1mL | 证明1-氯丁烷中含有氯元素 | |
| D | 0.1mol/LNaCl 溶液2mL | 0.1mol/LAgNO3溶液1mL | 0.1mol/LNa2S 溶液1mL | 证明AgCl大于Ag2S的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 | |
| B. | ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 | |
| C. | ③中采用了牺牲阳极的阴极保护法保护桥墩 | |
| D. | ①②③中海水均是实现化学能与电能相互转化的电解质 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 290 | 39 | 11.7 |
| 实验Ⅰ | 实验Ⅱ | |
| 通入气体 | CO、H2 | CO、H2、H2O(g) |
| 固体产物 | Fe3O4、Fe | Fe3O4 |

查看答案和解析>>
科目: 来源: 题型:解答题


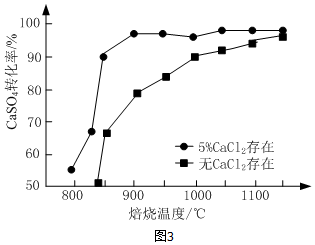
查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | 1076 | 465 | x |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol的  与足量的NaOH溶液反应,能消耗3mol NaOH 与足量的NaOH溶液反应,能消耗3mol NaOH | |
| B. | 可用氢氧化钠溶液除去乙酸乙酯中残留的乙酸 | |
| C. | 间二甲苯也叫1,5-二甲苯 | |
| D. | 乙二醇和丙三醇互为同系物 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Y、Z、W的简单离子半径Z>W>Y | B. | 工业上制取Y可用电解YW3制得 | ||
| C. | XW2中各原子均达到8电子结构 | D. | Z、W的氧化物对应水化物的酸性Z<W |
查看答案和解析>>
科目: 来源: 题型:解答题

 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$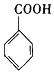
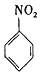 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (苯胺,易被氧化)
(苯胺,易被氧化) .
. .
. .
. 最合理的方案(不超过3步).
最合理的方案(不超过3步). $→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$
$→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com