
科目: 来源: 题型:多选题
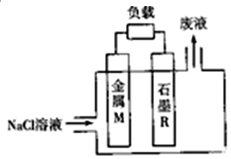 金属染料电池是一类特殊的染料电池,具有成本低、无毒、无污染、比功率高、比能量高(比能量可用单位质量金属提供电子多少来表示)等优点.锌、铁、铝、锂等金属都可用在金属燃料电池中,电池的基本结构如图所示:下列说法正确的是( )
金属染料电池是一类特殊的染料电池,具有成本低、无毒、无污染、比功率高、比能量高(比能量可用单位质量金属提供电子多少来表示)等优点.锌、铁、铝、锂等金属都可用在金属燃料电池中,电池的基本结构如图所示:下列说法正确的是( )| A. | 电池工作时,电子沿M电极→电解质溶液→R电极流动 | |
| B. | 电池工作时,正极附近溶液的pH增大 | |
| C. | 在锌、铁、铝、锂中,锂的比能量最高 | |
| D. | 若M为锌时,电池反应为 Zn+2H2O═Zn(OH)2+H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 原料甲与苯酚互为同系物 | |
| B. | 中间产物乙、丙和多巴胺都具有两性 | |
| C. | 多巴胺不可能存在氨基酸类的同分异构体 | |
| D. | 1 mol甲最多可以和2 mol Br2发生取代反应 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色. |
| ② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |

查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3:2 | B. | 2:3 | C. | 3:5 | D. | 3:4 |
查看答案和解析>>
科目: 来源: 题型:解答题

| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验 | ① | ② | ③ |
| 电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
| Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
| A. | 对比实验①②可知,降低pH可以提高Cr2O72-的去除率 | |
| B. | 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O | |
| C. | 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-被还原 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 $\stackrel{铑催化剂}{→}$
$\stackrel{铑催化剂}{→}$ (R1代表氢原子或烃基)
(R1代表氢原子或烃基)
 +
+ $\stackrel{碱}{→}$
$\stackrel{碱}{→}$ +H2O
+H2O .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com