
科目: 来源: 题型:解答题
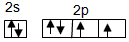 .
.查看答案和解析>>
科目: 来源: 题型:解答题
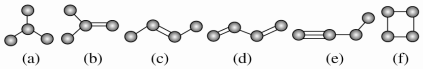
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 液态氟化氢分子间存在氢键,所以氟化氢的沸点比氯化氢高 | |
| B. | CH4、CO2、C2H2都是含有极性键的非极性分子 | |
| C. | [Cu(NH3)4]2+中含有离子键、极性键、配位键 | |
| D. | 因为非羟基氧原子数目逐渐减少,所以酸性HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第3周期元素氢化物的稳定性顺 序也是:HCl>H2S>PH3 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4,则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | NCl3中N原子是sp3杂化,则BCl3中B原子也是sp3杂化 | |
| D. | 干冰CO2是分子晶体,则SiO2也是分子晶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳原子之间,碳原子与其他原子(如氢原子)之间都可以形成4个共价键 | |
| B. | 碳原子性质活泼,可以与多数非金属元素原子形成共价键 | |
| C. | 碳原子之间既可以形成稳定的单键,又可以形成双键和三键 | |
| D. | 多个碳原子可以形成长度不同的链及环,且链、环之间又可以相互结合 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化硅的分子式为SiO2 | B. | 2-丁烯的键线式: | ||
| C. | 丙烷分子的球棍模型示意图: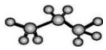 | D. | 乙烯的结构简式:CH2=CH2 |
查看答案和解析>>
科目: 来源: 题型:实验题
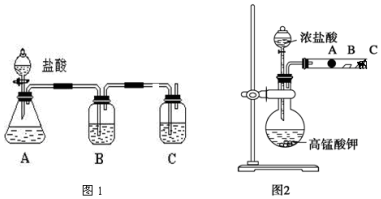
查看答案和解析>>
科目: 来源: 题型:推断题
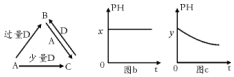
查看答案和解析>>
科目: 来源: 题型:选择题
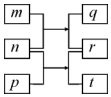 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一元强酸,t通常是固态单质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一元强酸,t通常是固态单质.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W>X>Y | B. | 元素的非金属性Z>X>Y | ||
| C. | X的氢化物常温常压下为液态 | D. | Y的最高价氧化物的水化物为弱酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某ⅡA族元素的原子序数为a,则原子序数为a+1的元素一定是ⅢA族元素 | |
| B. | 除短周期外,其他周期均有32种元素 | |
| C. | 原子最外层只有2个电子的元素可能是金属元素也可能是非金属元素 | |
| D. | 碱金属元素是指ⅠA族的所有元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com