
科目: 来源: 题型:解答题
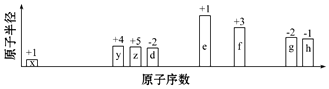
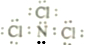 .
.查看答案和解析>>
科目: 来源: 题型:解答题
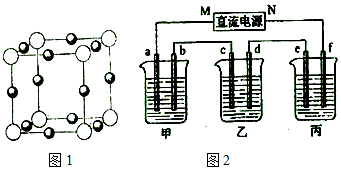
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 溶液中Ca2+数目减少 | B. | 溶液pH值增大 | ||
| C. | 溶液中c(Ca2+)增大 | D. | 溶液pH值不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Mg2+、Zn2+、Cr3+、Fe3+ | B. | Cr3+、Fe3+、Zn2+、Mg2+ | ||
| C. | Fe3+、Cr3+、Zn2+、Mg2+ | D. | Zn2+、Mg2+、Cr3+、Fe3+ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
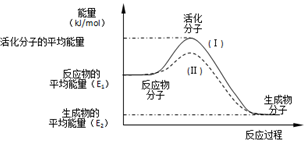 在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.
在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.查看答案和解析>>
科目: 来源: 题型:解答题
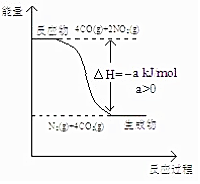 研究 NOx、SO2、CO 等大气污染气体的处理具有重要意义.
研究 NOx、SO2、CO 等大气污染气体的处理具有重要意义.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应①中化学能转化为热能 | |
| B. | 反应②中若生成液态铝则反应热应大于△H2 | |
| C. | 反应③中1molAlCl3(g)生成时,需要吸收174.9kJ的热量 | |
| D. | 该生产工艺中能循环利用的物质只有AlCl3 |
查看答案和解析>>
科目: 来源: 题型:填空题
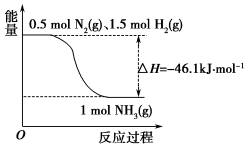 氨在工农业生产中应用广泛.
氨在工农业生产中应用广泛.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若c(Fe2+)与c(Cu2+)相等时,该反应达到平衡状态 | |
| B. | 向平衡体系中加入少量硫酸铜晶体后,FeS的KSP减小 | |
| C. | 其他条件不变,增大FeS的物质的量,该反应的正反应速率增大 | |
| D. | 该反应的化学平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com