
科目: 来源: 题型:选择题
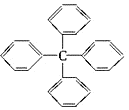 甲烷分子中的四个氢原子都可以被取代.若甲烷分子中的四个氢原子都被苯基取代,则可得到新分子(如图). 对该分子的描述不正确的是( )
甲烷分子中的四个氢原子都可以被取代.若甲烷分子中的四个氢原子都被苯基取代,则可得到新分子(如图). 对该分子的描述不正确的是( )| A. | 分子式为C25H20 | B. | 属于芳香烃 | ||
| C. | 该物质的一氯代物有3种 | D. | 所有碳原子可能都在同一平面上 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 离子化合物中只能含离子键 | |
| D. | 只有非金属原子间才能形成共价键 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
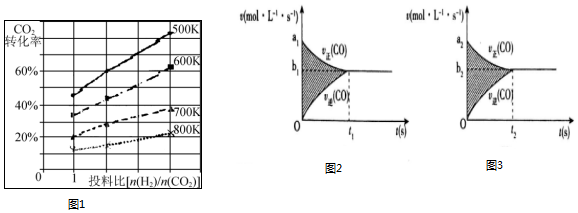
查看答案和解析>>
科目: 来源: 题型:选择题
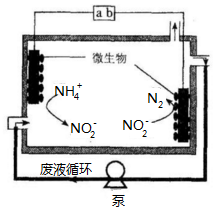 微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )
微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )| A. | a为电源的负极 | |
| B. | 右侧电极反应式为:2NO2-+6e-+4 H+=N2↑+4OH- | |
| C. | 电池工作一段时间后,溶液中NO2-的浓度不变 | |
| D. | 每通过3mol电子,最多处理0.5mol NH4+ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 时间(min) | 0 | t1 | t2 | t3 |
| NH3的物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
| A. | 0~t1min内,v(NH3)=$\frac{0.2}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移 | |
| C. | N2(g)+3H2(g)?2NH3(g)的活化能小于2NH3(g)?N2(g)+3H2(g)的活化能 | |
| D. | t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:多选题
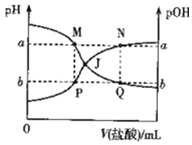
| A. | 曲线PJN表示溶液中pH的变化 | |
| B. | M点水的电离程度比Q点大 | |
| C. | M、P两点的数值之和a+b=14 | |
| D. | pH与pOH交叉点J对应的V(盐酸)=20.00 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com