
科目: 来源: 题型:选择题

| A. | 甲为C,X为O2 | B. | 甲为SO2,X为NaOH溶液 | ||
| C. | 甲为Fe,X为Cl2 | D. | 甲为硝酸溶液,X为Fe |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸的水溶液呈酸性,故酸性水溶液一定是酸的水溶液 | |
| B. | Fe3O4可写成FeO?Fe2O3;Pb3O4也可写成PbO?Pb2O3 | |
| C. | 工业上通过电解熔融MgCl2来制取金属镁;也可以通过电解熔融AlCl3来制取金属铝 | |
| D. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物稳定性顺序是HCl>H2S>PH3 |
查看答案和解析>>
科目: 来源: 题型:选择题
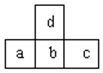
| A. | d的氢化物比b的氢化物稳定 | |
| B. | d与c不能形成化合物 | |
| C. | a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a | |
| D. | 原子半径的大小顺序是a>b>c>d |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)?2Q(g)△H<0的影响.下列有关说法正确的是(反应容器的体积不变)( )
如图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)?2Q(g)△H<0的影响.下列有关说法正确的是(反应容器的体积不变)( )| A. | x可能表示该反应的平衡常数 | |
| B. | x可能表示平衡混合物的密度 | |
| C. | 当x表示Q的体积分数时,T2<T1 | |
| D. | 当x表示平衡混合物的物质的量时,T2<T1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯水(AgNO3溶液) | B. | NaOH溶液[Ba(OH)2溶液] | ||
| C. | FeSO4溶液(KSCN溶液) | D. | KI溶液(淀粉溶液) |
查看答案和解析>>
科目: 来源: 题型:解答题
 将水分解制得氢气的一种工业方法是“硫-碘循环法”,依次涉及下列三步反应:
将水分解制得氢气的一种工业方法是“硫-碘循环法”,依次涉及下列三步反应:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 终点溶液偏碱性 | B. | 终点溶液中c(NH4+)=c(Cl-) | ||
| C. | 终点溶液中氨过量 | D. | 合适的指示剂是甲基橙而非酚酞 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 化学键 | H-H | C-H | C-C | C=C |
| 键能(kJ•mol-1) | 436 | 413 | 348 | 612 |
查看答案和解析>>
科目: 来源: 题型:解答题

| NaCl浓度(g.L-1) 温度(℃) | 20 | 40 | 60 | 100 | 180 | 260 | 300 |
| 13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
| 50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
| 100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com