
科目: 来源: 题型:选择题
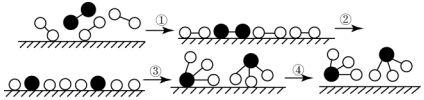
| A. | 该过程表明,在化学反应中存在化学键的断裂与形成 | |
| B. | 在催化剂的作用下,反应物的化学键变得容易断裂 | |
| C. | 过程②需吸收能量,过程③则放出能量 | |
| D. | 常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,液态水的汽化热为40.69 kJ•mol-1,则H2O(g)?H2O(l)△H=40.69 kJ•mol-1 | |||||||||||
| B. | 已知:
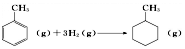 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 | |||||||||||
| C. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 | |||||||||||
| D. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目: 来源: 题型:解答题
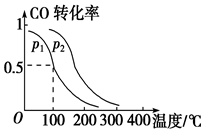 运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
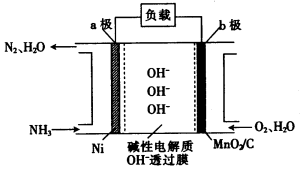
查看答案和解析>>
科目: 来源: 题型:解答题
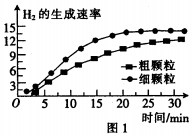

查看答案和解析>>
科目: 来源: 题型:解答题
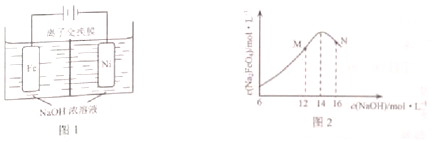
查看答案和解析>>
科目: 来源: 题型:多选题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应放热 | |
| B. | 达到平衡时,容器I中反应物转化率比容器Ⅱ中的小 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的正反应速率比容器I中的大 |
查看答案和解析>>
科目: 来源: 题型:实验题
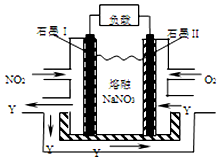 汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.
汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.| 实验编号 | 温度 | 0分钟 | 10分钟 | 20分钟 | 40分钟 | 50分钟 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com