
科目: 来源: 题型:选择题
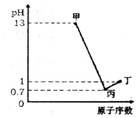 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁,常温下甲、丙、丁均可与乙反应生成盐和水,X、Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )| A. | 简单阴离子的还原性:Z<W | |
| B. | X、Y分别与W形成的化合物皆为离子化合物 | |
| C. | 乙固体中加入甲的溶液或浓氨水,固体都能溶解 | |
| D. | Y、Z的简单离子都会影响水的电离平衡 |
查看答案和解析>>
科目: 来源: 题型:解答题
 和苯甲酸异丙酯流程如下(部分条件已经略去):
和苯甲酸异丙酯流程如下(部分条件已经略去):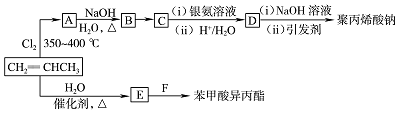
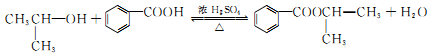 .
.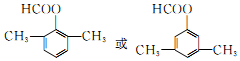 .
.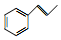 和F为原料(无机试剂任选),设计制备有机物
和F为原料(无机试剂任选),设计制备有机物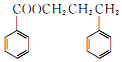 的合成路线.
的合成路线.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙炔通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色 | |
| B. | 甲苯在一定条件下与浓硝酸反应生成三硝基甲苯 | |
| C. | 乙醇在一定条件下与氢溴酸反应生成溴乙烷 | |
| D. | 在一定条件下苯与氢气反应制取环己烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
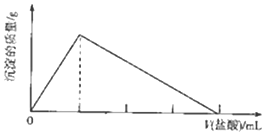 短周期主族元素R、X、Y、Z的原子序数依次增大,R的气态氢化物能使湿润的红色石蕊试纸变蓝色;X原子的核外电子数与价电子数之比为4:3,X和Y组成两种离子化合物,其中一种可作航天器中的供氧剂.向YZX2的溶液中滴加元素,产生沉淀的质量与盐酸体积的关系如图所示.下列说法不正确的是( )
短周期主族元素R、X、Y、Z的原子序数依次增大,R的气态氢化物能使湿润的红色石蕊试纸变蓝色;X原子的核外电子数与价电子数之比为4:3,X和Y组成两种离子化合物,其中一种可作航天器中的供氧剂.向YZX2的溶液中滴加元素,产生沉淀的质量与盐酸体积的关系如图所示.下列说法不正确的是( )| A. | 气态氢化物的稳定性:X>R | |
| B. | 简单离子半径:X>Y>Z | |
| C. | R的最高价氧化物对应的水化物是一种强酸 | |
| D. | 用Z的单质与Y的氧化物反应可冶炼Y的单质 |
查看答案和解析>>
科目: 来源: 题型:选择题
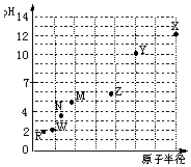 同一短周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )
同一短周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )| A. | 气态氢化物的稳定性:M>N | |
| B. | Z的最高价氧化物能溶于稀氨水 | |
| C. | X和W形成的常见化合物中阴、阳离子个数比为2:1 | |
| D. | Z和R的简单离子半径:Z3+<R- |
查看答案和解析>>
科目: 来源: 题型:实验题
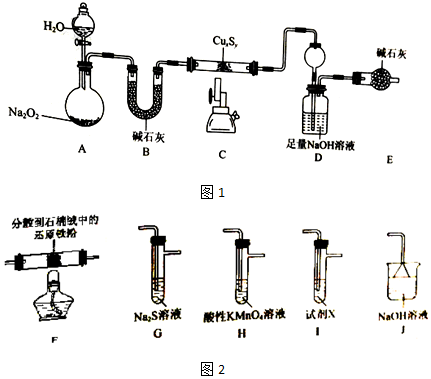
查看答案和解析>>
科目: 来源: 题型:选择题
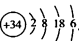 下列说法正确的是( )
下列说法正确的是( )| A. | Se位于第4周期第ⅣA族 | B. | 原子半径:Br>Se>P | ||
| C. | 热稳定性:HCl>H2Se>HBr | D. | 酸性:HClO4>HBrO4>H2SeO4 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡.测得反应后溶液pH=0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
| 操作 | 现象 |
| 取2mL 5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊.测得反应后溶液pH=1.4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时正极上的电极反应为:Li-e-═Li+ | |
| B. | 该充电宝的凝胶介质可用KOH水溶液代替 | |
| C. | 充电时每生成14g Li,凝胶介质中有2mol电子通过 | |
| D. | 充电时电池的正极失电子后Li4V2O3会转化为V2O3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S Cl 的原子半径依次减小 | |
| B. | Na Mg 的失电子能力依次增强 | |
| C. | O F的气态氢化物的稳定性依次增强 | |
| D. | Si P 的最高价含氧酸的酸性依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com