
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 制备乙炔时,减缓乙炔的生成速率 | 用饱和食盐水替代水跟电石反应 |
| B | 证明NH4Cl溶液能促进Mg(OH)2固体的溶解 | 向两份等量的Mg(OH)2固体中分别加入等体积的蒸馏水和NH4Cl溶液 |
| C | 验证乙醇发生消去反应生成乙烯 | 将生成的气体直接通入含Br2的CCl4溶液中 |
| D | 证明Al2O3的熔点比Al高 | 把砂纸打磨过的铝箔在酒精灯上加热至熔化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | 乳酸分子[CH3-CH(OH)-COOH]中有 1 个手性碳且 1 mol 该分子中有 11 mol σ 键 | |
| C. | PCl5分子中P原子和Cl原子最外层都满足8电子结构 | |
| D. | H-O键键能为463 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;
;查看答案和解析>>
科目: 来源: 题型:填空题
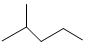 表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.
表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.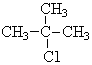 .
.查看答案和解析>>
科目: 来源: 题型:解答题
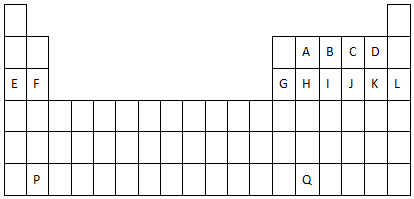
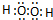 .
. ,用电子式表示A2C的形成过程.
,用电子式表示A2C的形成过程.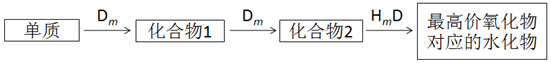
查看答案和解析>>
科目: 来源: 题型:解答题
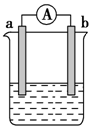 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 75.77%表示35Cl的质量分数 | |
| B. | 24.23%表示35Cl在自然界所占的原子个数百分比 | |
| C. | 35.453表示氯元素的相对原子质量 | |
| D. | 36.966表示37Cl的质量数 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验序号 | 实验步骤 | 实验现象 |
| ① | 将一小块金属钠放入滴有酚酞溶液的冷水中. | B |
| ② | 将磨去表面氧化膜的一小段镁条放入试管中,加入2mL水,滴入2滴酚酞溶液,加热至水沸腾. | D |
| ③ | 将磨去表面氧化膜的一小段镁条投入2mL 1mol/L盐酸中. | A |
| ④ | 将磨去表面氧化膜的一小片铝投入2mL 1mol/L盐酸中. | C |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 随着原子序数的增大,元素的主要化合价逐渐增加 | |
| B. | 随着随着相对原子质量的增大,元素的化学性质会不断重复 | |
| C. | 与碱金属相比,其相邻主族的(碱土)金属具有更小的密度和硬度 | |
| D. | 卤素氢化物的稳定性随着核电荷数的增加而减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com