
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
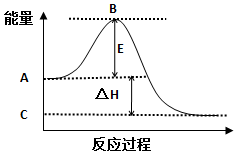
查看答案和解析>>
科目: 来源: 题型:解答题
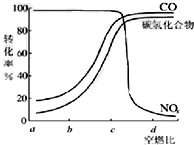 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
查看答案和解析>>
科目: 来源: 题型:实验题
 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I CO2(g)+H2(g)?CO(g)+H2O(g)△H2Ⅱ
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I CO2(g)+H2(g)?CO(g)+H2O(g)△H2Ⅱ| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
查看答案和解析>>
科目: 来源: 题型:填空题
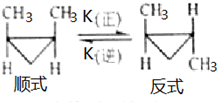 顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图转化:
顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图转化:查看答案和解析>>
科目: 来源: 题型:选择题
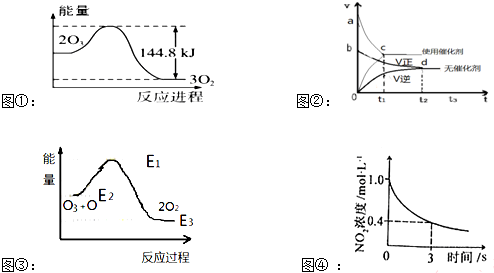
| A. | 据图①可判断:2O3(g)=3O2(g);△H=-44.8KJ/mol | |
| B. | 据图②可判断:某反应在使用催化剂时比无催化剂时反应速率大,且面积Saco>Sbdo | |
| C. | 据图③可判断:2O2(g)═O3(g)+O(g)△H>0 | |
| D. | 据图④可判断:2NO2(g)+O3(g)?N2O5(g)+O2(g),0~3s内,反应速率为V(N2O5)=0.2mol•L-1•S-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
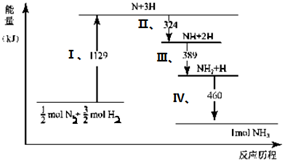
| A. | Ⅰ中1129 kJ为该反应过程的活化能 | |
| B. | N2(g)+3H2 (g)?2NH3 (g)△H=2(324+389+460-1129)kJ/mol | |
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | |
| D. | N2(g)+3H2 (g)?2NH3 (g)△H>0 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 检验淀粉已完全水解;在淀粉水解液中滴加碘水 | |
| B. | 证明氧化性H2O2比Fe3+强,将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | |
| C. | 检验某溶液中含Fe2+:可先向溶液中加入氯气,再滴加少量KSCN溶液 | |
| D. | 把0.9mol•L-1硫酸100mL;将18 mol•L-1硫酸5mL移入100mL容量瓶,加水至刻度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气态氢化物的热稳定性:b<c | B. | 含d元素的盐溶液可能呈碱性 | ||
| C. | 原子半径:d>c>b>a | D. | a、b和c三种元素能形成离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com