
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
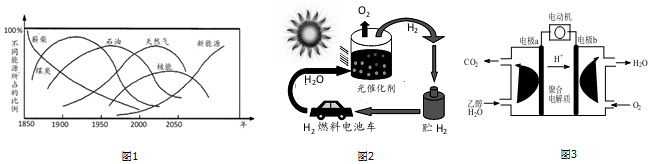
| A. | 停止北方冬季供暖,减少有害物质排放 | |
| B. | 寻找新能源,减少化石燃料的使用 | |
| C. | 退耕还林,改善生态环境 | |
| D. | 对锅炉和汽车等产生的有害气体和烟尘等进行处理 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol氢气含有的原子数为NA | |
| B. | NA个水分子中含有氢原子的物质的量为2 mol | |
| C. | 1 mol 氧气中含有的分子数为2NA | |
| D. | 1 mol任何物质都含有NA个分子 |
查看答案和解析>>
科目: 来源: 题型:选择题
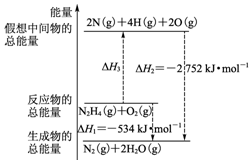 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:| 化学键 | N-N | O=O | N≡N | N-H |
| 键能(kJ) | 154 | 500 | 942 | a |
| A. | N2比O2稳定 | |
| B. | N2H4(g)+O2(g)?N2(g)+2H2O(g)△H=-534 kJ•mol-1 | |
| C. | 表中的a=194 | |
| D. | 图中的△H3=+2218 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
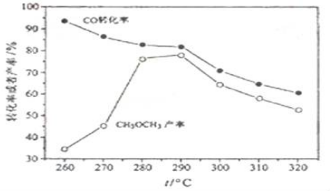 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
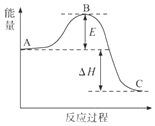 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1 查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
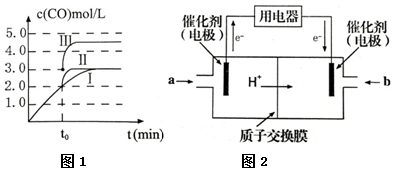
查看答案和解析>>
科目: 来源: 题型:解答题
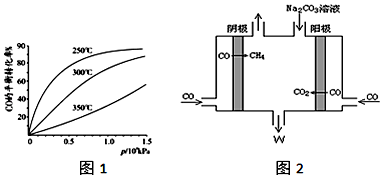
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com