
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
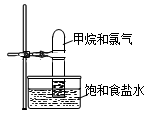 将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升.
将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升.查看答案和解析>>
科目: 来源: 题型:解答题
| 水 | Na2CO3 | 混合前温度 | 混合后温度 |
| 35mL | 3.2g | 20℃ | 24.3℃ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 将0.1mol•L-1MgSO4溶液滴入 过量NaOH溶液,再滴加几滴0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成,后有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落下来 | 铝箔表面有致密Al2O3薄膜,Al2O3且熔点高于Al |
| C | 向新收集的酸雨中滴加硝酸钡溶液 | 产生白色沉淀 | 酸雨中一定含有SO42- |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为了防止白色污染应回收废旧塑料并加以焚烧 | |
| B. | 手机壳上贴的碳纤维膜是一种新型无机非金属材料 | |
| C. | 当今雾霾天气频发是由于人类活动对自然环境的影响所造成的 | |
| D. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | Cl-Cl | O=O | O-H | H-Cl |
| 键能(kJ.mol-1) | 247 | 498 | 463 | 431 |
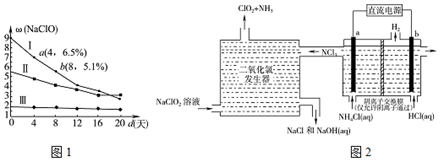
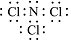 .
.查看答案和解析>>
科目: 来源: 题型:解答题
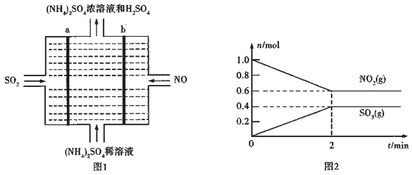
查看答案和解析>>
科目: 来源: 题型:实验题
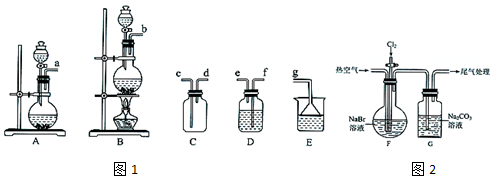
| 操作步骤 | 实验现象 | 结论或解释 |
| ①去适量G中溶液于试管中,加入硫酸酸化 | 产生气泡 | G中溶液含有CO32-或HCO3- |
| 向①的试管中加入CCl4,振荡,静置 | ②溶液分层,下层为棕红色 | 生成单质溴 |
查看答案和解析>>
科目: 来源: 题型:解答题
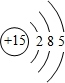 .
.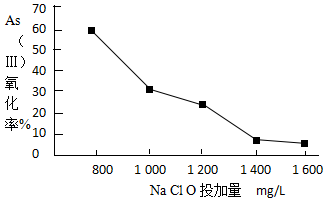
| pH | <2 | 2~7 | 7~11 | 11~14 |
| 存在形式 | H3AsO4 | H2AsO3- | HAsO42- | HAsO42-、AsO43- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com