
科目: 来源: 题型:选择题
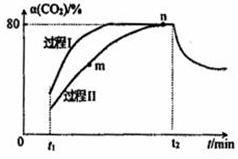 一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )
一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )| A. | m点:v(正)>v(逆) | |
| B. | 活化能:过程Ⅱ>过程I | |
| C. | n点时该反应的平衡常数K=50 | |
| D. | 过程I,t2时刻改变的反应条件可能是升高温度 |
查看答案和解析>>
科目: 来源: 题型:选择题
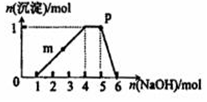 某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )| A. | m点处反应:H++OH-═H2O | |
| B. | p点:c(NH4+)>c(OH-)>c(H+) | |
| C. | 若取原溶液做焰色反应实验,焰色应为黄色 | |
| D. | 原溶液中存在的主要离子:n(H+)=n(NH4+)=n(Al3+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由反应①知H2的燃烧热为571.6kJ/mol | |
| B. | 反应②中生成物的总能量高于反应物的总能量 | |
| C. | 反应③若改用新催化剂,△H3不变化 | |
| D. | 反应CH4(g)═C(s)+2H2(g)的△H=+74.8kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.160 | 0.143 | 0.070 | 0.066 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | 元素的金属性:X<Y | |
| B. | 原子Z的价电子数为5 | |
| C. | 元素的简单离子半径:r(X2+)>r(W2-) | |
| D. | 元素Y的最高价氧化物对应的水化物能溶于氨水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中子数为10 的氧原子:10O | |
| B. | 过氧化氢的电子式:H-O-O-H | |
| C. | CS2中各原子最外层都满足8 电子结构 | |
| D. | CH2Cl2是四面体构型的含非极性健的分子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钾保存在乙醇中 | |
| B. | 常温下浓硫酸可存放在铁质容器中 | |
| C. | NaOH溶液保存在玻璃塞的试剂瓶中 | |
| D. | FeCl3溶液中加入少量还原铁粉存放 |
查看答案和解析>>
科目: 来源: 题型:解答题
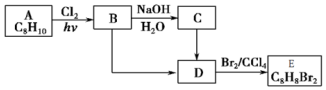
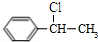 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$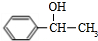 +NaCl;
+NaCl;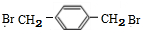 (写结构简式).
(写结构简式).查看答案和解析>>
科目: 来源: 题型:实验题
 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 甲 | 乙 | 丙 | 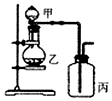 |
| A | 证明浓硫酸具有强氧化性 | 浓硫酸 | 碳粉 | 溴水 | |
| B | 验证Cl2无漂白性 | 浓盐酸 | MnO2 | 干燥的红色布条 | |
| C | 验证NH3溶于水显碱性 | 浓氨水 | 碱石灰 | 湿润的蓝色石蕊试纸 | |
| D | 比较H2CO3和H2SiO3的酸性 | 硼酸溶液 | 碳酸钠 | 硅酸钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al2O3$\stackrel{盐酸}{→}$AlCl3溶液$\stackrel{通电}{→}$Al | |
| B. | NH3$→_{△}^{O_{2}/催化剂}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | SiO2$\stackrel{NaOH溶液}{→}$Na2SiO3溶液$\stackrel{CO_{2}}{→}$H2SiO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com