
科目: 来源: 题型:选择题
| A. | c1:c2=3:1 | |
| B. | 平衡时.Y和Z的生成速率之比为2:3 | |
| C. | X、Y的转化率不相等 | |
| D. | c1 的取值范围为 0 mol/L<c1<0.14 mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素B的化合物可以用来做焰火材料 | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素B、D的最高价氧化物对应的水化物之间可能发生反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 甲装置工作过程中pH增大 | |
| B. | 乙装置中石墨电极反应式为C-4e-+2O2-═CO2↑ | |
| C. | 甲装置中通入O2的电极反应式为:O2+4e-+4H+═2H2O | |
| D. | 若不考虑装置的损失,制备24.0g金属钛,需要消耗氢气22.4L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,向0.1mol/LNH4HSO4溶液中滴加NaOH溶液至中性C(Na+)>c(SO42-)>c(NH4+)>c(OH-)=C(H+) | |
| B. | 向饱和NaClO溶液中滴加少量饱和FeSO4溶液,反应的离子方程式为2Fe2++ClO-+5H2O═2Fe(OH)3↓+Cl-+4H+ | |
| C. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH2COO-)-c(CH2COOH) | |
| D. | 常温下cmol/L、电离常数为Ka的酸HA溶液中,由水电离的浓度为c(H+)水=$\frac{1{0}^{-14}}{\sqrt{Ka•c}}$mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 核外电子排布相同的微粒化学性质相同 | |
| B. | 非金属的气态氢化物的稳定性越强其沸点就越高 | |
| C. | 同主族元素形成的单质熔、沸点随元素核电荷数的递增而逐渐降低 | |
| D. | 同主族非金属元素最高价氧化物对应水化物的酸性随核电荷数的增加而减弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二者分别与少量邻羟基苯甲酸作用,所得产物相同 | |
| B. | 若将二者均配成0.1mol/L的溶液,前者的pH较大 | |
| C. | 分别加入过量盐酸充分反应后,二者产生CO2的体积在标准状况下均为2.24L | |
| D. | 若将二者分别加入1mL水中充分搅拌,恢复至室温后,只有后者有固体剩余 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 充分利用太阳能,进行海水淡化 | |
| B. | 将秸秆露天焚烧,从而充分利用生物质能 | |
| C. | 以二氧化硅为光电池材料,将太阳能转化为电能 | |
| D. | 用甲烷与水作用生产清洁能源--H2,该过程的原子利用率为100% |
查看答案和解析>>
科目: 来源: 题型:解答题
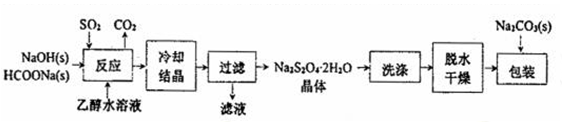

| 绝热恒容(2L ) 密闭容器A | 恒温(T℃)恒容(2L) 密闭容器B | 恒温(T℃)恒压 密闭容器C | |
| 平衡常数K | KA | KB | KC |
| SO2的平衡转化率 | αA | αB | αC |
查看答案和解析>>
科目: 来源: 题型:实验题
| 【系列一】实验 | 溶液X | 实验现象 | |
| 实验Ⅰ | 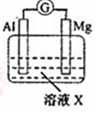 | 1mol/L稀硝酸 | 观察到电流计指针向左偏转. |
| 实验Ⅱ | 6mol/L稀硝酸 | 观察到电流计指针向左偏转,铝片表面产生无色气体,在液面上方变为红棕色 | |
| 实验Ⅲ | 6mol/LNaOH溶液 | 观察到(现象写在答题处). | |
| 实验Ⅳ | 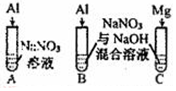 | A、C中均无明显现象,B中有无色气体生成. | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com