
科目: 来源: 题型:选择题
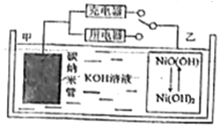 氢燃料电池具有广阔前景.某二次氢燃料电池的原理如图所示,该电池用吸附了H2的碳纳米管等材料制作而成,下列说法正确的是( )
氢燃料电池具有广阔前景.某二次氢燃料电池的原理如图所示,该电池用吸附了H2的碳纳米管等材料制作而成,下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 可开发氢燃料电池用于电动汽车 | |
| C. | 电池总反应为H2+NiO(OH)$?_{充电}^{放电}$Ni(OH)2 | |
| D. | 充电时,乙电极反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4HCO3受热易分解,可用作氮肥 | |
| B. | Na2CO3具有碱性,可用作胃酸中和剂 | |
| C. | SiO2易传导光信号,可用作光导纤维 | |
| D. | Ca(ClO)2在空气中不稳定,可用于漂白纸张 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | S2-的结构示意图: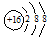 | ||
| C. | CaO2的电子式: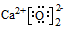 | D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe3O4 | B. | FeO | C. | Fe2O3 | D. | Fe5O7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碱性:Ca(OH)2>Mg(OH)2 | B. | 酸性:H2SO3>H2CO3 | ||
| C. | 热稳定性:NH3<PH3 | D. | 还原性:S2-<Cl- |
查看答案和解析>>
科目: 来源: 题型:解答题
周期 族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
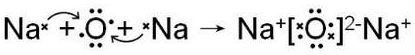 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.
为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | lmol N2、3molH2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | C甲 | C乙 | C丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | v甲 | V乙 | V丙 |
| A. | V甲>V丙 | B. | C乙>C甲 | C. | K乙>K丙 | D. | V甲=V丙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com