
科目: 来源: 题型:选择题
| A. | 10:1 | B. | 1:10 | C. | 9:2 | D. | 2:9 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验要求 | 化学试剂 |
| (1)检验酒精中是否有水 | ④ |
| (2)吸收CO中的H2O | ② |
| (3)验证味精中是否有食盐 | ① |
| (4)分离碘水中的碘 | ③ |
查看答案和解析>>
科目: 来源: 题型:解答题
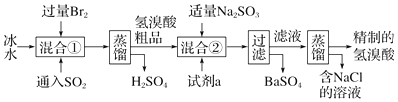
查看答案和解析>>
科目: 来源: 题型:实验题
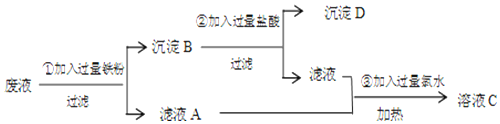
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | Li | Be | B | C | O | F |
| X值 | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| X值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
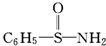 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 人造纤维、合成纤维和光导纤维都是有机离分子化合物 | |
| C. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| D. | 可用Si2N4、Al2O3制作高温结构陶瓷制品 |
查看答案和解析>>
科目: 来源: 题型:解答题
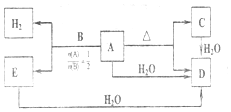
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
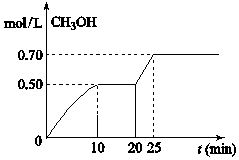 在容积固定为2L的密闭容器中,充入2molCO2和6molH2,在温度500℃时发生反应,CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,CH3OH的浓度随时间变化如右图,下列说法正确的是( )
在容积固定为2L的密闭容器中,充入2molCO2和6molH2,在温度500℃时发生反应,CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,CH3OH的浓度随时间变化如右图,下列说法正确的是( )| A. | 从开始到25分钟,CO2的转化率是35% | |
| B. | 从20分钟到25分钟,可能是缩小容器体积 | |
| C. | 其它条件不变,将温度升到800℃,平衡常数增大 | |
| D. | 从反应开始到10分钟,H2的平均反应速率v(H2)=0.15mol(L•min) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | X | Y | Z | W |
| 性质 结构 信息 | 工业上常用电解熔融XW2制取X的单质. | Y的最外层电子数比最内层电子数多1. | Z的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂. | W的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强. |
 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
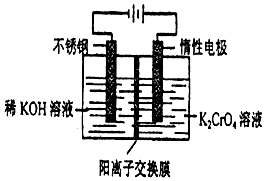 以10L 0.1mol/L铬酸钾(K2CrO4)溶液为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如下,下列说法不正确的是( )
以10L 0.1mol/L铬酸钾(K2CrO4)溶液为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如下,下列说法不正确的是( )| A. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| B. | 在阴极室,通电后KOH溶液不断变浓,并产生气体H2 | |
| C. | CrO42-通过离子交换膜从阳极区域迁移到阴极区域 | |
| D. | 电解一段时间后测定阳极液中K和Cr的物质的量之比为d,则导线中转移电子的物质的量为(2-d)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com