
科目: 来源: 题型:填空题
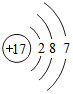 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电过程中,正极的电极反应式为NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 放电时,电子由负极→正极→电解质溶液→负极,形成闭合回路 | |
| C. | 充电时,阴极附近溶液pH 降低 | |
| D. | 充电过程中,OH-从阳极向阴极迁移 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
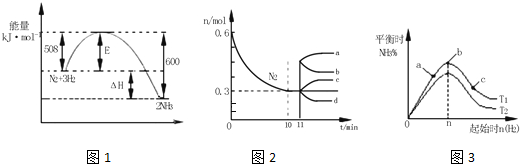
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  量取10.00mLNaOH溶液 | |
| B. |  蒸干氯化铜溶液制CuCl2•2H2O | |
| C. | 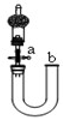 关闭活塞a,从b处加水,以检查装置的气密性 | |
| D. | 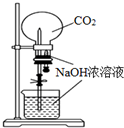 用CO2做喷泉实验 |
查看答案和解析>>
科目: 来源: 题型:解答题
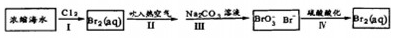
查看答案和解析>>
科目: 来源: 题型:解答题
 在容积为2L的密闭容器中,投入2molA和3molB发生反应:A(s)+2B(g)?2C(g),B的物质的量的变化如图所示.已知:2~t1时段的正反应速率比t2~t3时段的正反应速率快.
在容积为2L的密闭容器中,投入2molA和3molB发生反应:A(s)+2B(g)?2C(g),B的物质的量的变化如图所示.已知:2~t1时段的正反应速率比t2~t3时段的正反应速率快.查看答案和解析>>
科目: 来源: 题型:解答题
 某学习小组用下列实验方案来制备乙酸乙酯,装置(夹持装置省略)如图.
某学习小组用下列实验方案来制备乙酸乙酯,装置(夹持装置省略)如图. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.| 密度/(g•cm-3) | 沸点/℃ | |
| 乙酸 | 1.05 | 118.1 |
| 乙醇 | 0.780 | 78.3 |
| 乙酸乙酯 | 0.905 | 77.2 |
查看答案和解析>>
科目: 来源: 题型:选择题
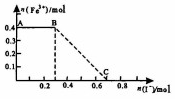 将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )
将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )| A. | 参加反应的铁粉为0.4mol | |
| B. | 氧化性:HNO3>I2 | |
| C. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| D. | 稀硝酸的浓度为0.5mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com