
科目: 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:填空题
(1)化学平衡常数K表示可逆反应进行程度,K值越大,表示  ,K值大小与温度的关系是:△H<0(正反应放热),当温度升高K值 。
,K值大小与温度的关系是:△H<0(正反应放热),当温度升高K值 。
(2)在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g) + H2O(g) CO2(g)+H2(g) △H<0,CO和H2O浓度变化如下图所示,则0~4min的平均速率v(CO)= 。
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如下图所示,则0~4min的平均速率v(CO)= 。

(3)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
t1℃时物质浓度(mol/L)的变化
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①表中3~4min反应处于 状态;c1数值 0.08mol/L(填“>”“<”“=”)
②反应在4~5min,平衡向逆方向移动,可能的原因是 (单选),表中5~6min数值发生变化,可能的原因是 (单选)
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
查看答案和解析>>
科目: 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:填空题
Ⅰ.反应:aA(g) + bB(g)  cC(g) △H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
cC(g) △H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
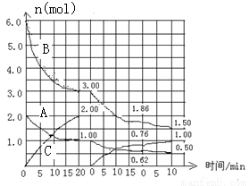
回答问题:
(1)反应的化学方程式中,a:b:c == 。
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)比较第二阶段反应温度(T2)和第三阶段反应温度(T3)的高低:T2 T3(填“>”“<”或“=”),判断的理由是 。
(4)第三阶段平衡常数K3的计算式 。
Ⅱ.利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体。
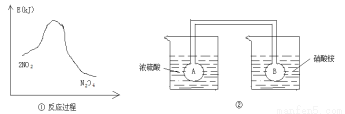
(5)B瓶中的气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。
查看答案和解析>>
科目: 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:填空题
Ⅰ.已知:Na2S2O3+H2SO4==Na2SO4+SO2↑+S ↓+H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
↓+H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度 | Na2S2O3浓度[ | 稀硫酸 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)该实验①、②可探究 对反应速率的影响,因此V1、V2和V3分别是 、 、 。
(2)实验①、③可探究 对反应速率的影响,因此V4、V5分别是 、 。
Ⅱ.二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。如图中的曲线表示二氧化氮分解反应在前25秒内的反应进程。
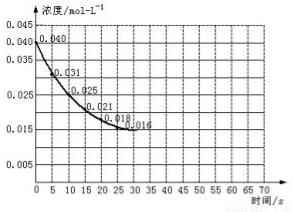
(3)前20秒内氧气的平均生成速率 mol/(L·s)
(4)在某温度下达到平衡时的平衡常数表达式是 。
(5)在某温度下达到平衡后,不改变其它条件,向该容器中再加入少量的NO2,平衡移动的方向是 ,NO2的平衡转化率 68.75%(填“>”、“<”或“=”),NO的体积百分含量 (填“增大”、“减小”或“不变”)。
(6)若在反应开始时加入催化剂(其他条件都不变),反应经过20秒达到平衡,请在图上用虚线画出加催化剂后反应0~70s的曲线。
查看答案和解析>>
科目: 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:填空题
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
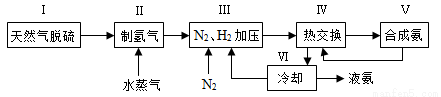
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:____________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g)ΔH=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH=-41.2kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 __。
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
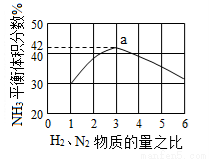
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)_____________。简述本流程中提高合成氨原料总转化率的方法:_____________________。
查看答案和解析>>
科目: 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.凡有能量变化的过程都是化学变化
B.吸热反应只能在加热条件下才能进行
C.放热反应可能需要加热才能进行
D.天然气在空气中燃烧时,其化学能将全部转化为热能
查看答案和解析>>
科目: 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
热化学方程式C(s)+H2O(g)==CO(g)+H2(g) ΔH=+131.3 kJ/mol表示( )
A.碳和水反应吸收131.3 kJ能量
B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,吸收热量131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ
查看答案和解析>>
科目: 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态水时放出445 kJ的热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g)==2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1
B.CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1
C.CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
D. 1/2CH4(g)+O2(g)==1/2CO2(g)+H2O(l) ΔH=-890 kJ·mol-1[来源:
查看答案和解析>>
科目: 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
化学键 | H—H | Br—Br | H—Br |
键能/(kJ·mol-1) | 436 | 193 | 366 |
请计算H2(g)+Br2(g)==2HBr(g)的反应热( )
A.+103 kJ·mol-1 B.+679 kJ·mol-1 C.-103 kJ·mol-1 D.+183 kJ·mol-1
查看答案和解析>>
科目: 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
下列说法或表示方法正确的是( )
A.反应物总能量低于生成物总能量,该反应不能发生
B.中和热一定是强酸跟强碱反应放出的热量
C.由石墨比金刚石稳定,可知C(石墨)==C(金刚石) ΔH>0
D.在101 kPa、25 ℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)==2H2O(l) ΔH=-285.8 kJ·mol-1
查看答案和解析>>
科目: 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
强酸和强碱在稀溶液里反应的热化学方程式可表示为:
H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ·mol-1
已知:CH3COOH(aq)+NaOH(aq)==CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
HNO3(aq)+NaOH(aq)==NaNO3(aq)+H2O(l)ΔH=-Q2 kJ·mol-1
上述均是在溶液中进行的反应,Q1、Q2的关系正确的是( )
A.Q1=Q2=57.3 B.Q1>Q2>57.3 C.Q1<Q2=57.3 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com