
科目: 来源: 题型:解答题
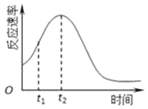 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 40 | 100 | 60 | t1 |
| ② | 常温 | A | B | C | 60 | t2 |
| ③ | 常温 | 3 | 80 | D | E | t3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5:6 | B. | 6:5 | C. | 3:5 | D. | 5:3 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | |
| 体积(mL) | 浓度(mol/L) | |||
| 1 | 25 | 0.5 | 4.00 | 0.1000 |
| 2 | 50 | 0.5 | 4.00 | 0.1000 |
| 3 | 25 | 0.5 | 4.00 | 0.0100 |
| 4 | 25 | 0 | 4.00 | 0.1000 |
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第 1 次 | 第 2 次 | 第 3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 2 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡体系中C的体积分数为$\frac{1}{9}$ | B. | 平衡时A的浓度为2.4mol/L | ||
| C. | D的平均速率为0.32mol/L•min | D. | B的转化率为20% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4NH3(g)+5O2(g)═4 NO(g)+6 H2O(g)△H=+a kJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H=-b kJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g)△H=-c kJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(g)△H=-d kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:多选题
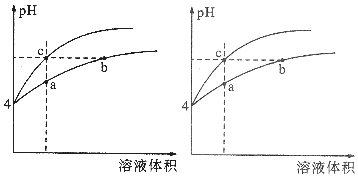 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、c两点溶液的导电能力相同 | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol金属钠含有的电子数 | |
| B. | 标准状况下,22.4L酒精所含的分子数 | |
| C. | 12g12C所含的原子数 | |
| D. | 1L 1mol/L的硫酸溶液中所含的H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 14g氮气含有的原子数为0.5NA | |
| B. | 4 g金属钙变成钙离子时失去的电子数为0.1NA | |
| C. | 1 mol O2分子的质量等于1 mol氧原子的质量 | |
| D. | 16 g O2分子和16g O3分子所含的氧原子数目相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol H2和0.5 mol O2反应放出的热量就是H2的燃烧热 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,相同条件下,前者放出的热量多 | |
| C. | 水中的钢闸门连接电源的负极,属于外加电流的阴极保护法 | |
| D. | 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com