
科目: 来源: 题型:选择题
| A. | 18g2H2O中含有的电子数目为NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离+数为0.05NA | |
| C. | 常温常压,22.4LC12中含有的分子数为6.02×1023个 | |
| D. | 常温常压下,足量的金属Al与lmolCl2共热,转移电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、K+、Cl-、NO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、Ag+、NO3-、HCO3- | D. | Na+、NH4+、CO32-、OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁在熔融状态下能导电,所以铁是电解质 | |
| B. | 氯化氢在熔融状态下不导电,所以氯化氢是非电解质 | |
| C. | 氯气的水溶液能导电,所以氯气是电解质 | |
| D. | 电解质和非电解质都是纯净物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 把Mg粉放入FeCl3溶液中:2Fe3++3Mg+6H2O=2Fe(OH)3↓+3 Mg2++3H2↑ | |
| B. | 用漂白粉溶液吸收尾气中SO2:Ca2++2ClO?+SO2+H2O=CaSO3↓+2HClO | |
| C. | 氯化铝溶液中加入偏铝酸钠溶液:Al3++3AlO2-+6H2O=4Al(OH)3↓ | |
| D. | 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | M层的电子数为K层电子数的3倍 |
| Y | 短周期中最活泼的金属元素 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 元素最高正价是+7价 |
查看答案和解析>>
科目: 来源: 题型:解答题
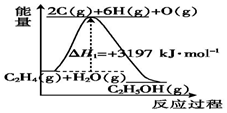 乙醇用途广泛,常用作溶剂、饮料、燃料等.
乙醇用途广泛,常用作溶剂、饮料、燃料等.查看答案和解析>>
科目: 来源: 题型:解答题
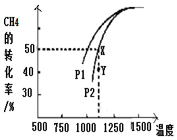 研究含氮、硫污染物的治理是环保的一项重要工作.
研究含氮、硫污染物的治理是环保的一项重要工作.查看答案和解析>>
科目: 来源: 题型:解答题
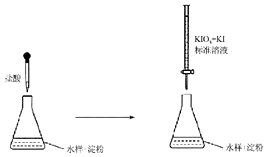 含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.
含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.查看答案和解析>>
科目: 来源: 题型:实验题
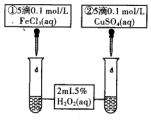 取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响.
取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响.| 序号 | 条件 | |
| 温度/℃ | 催化剂 | |
| 1 | 40 | FeCl3溶液 |
| 2 | 20 | FeCl3溶液 |
| 3 | 20 | MnO2 |
| 4 | 20 | 无 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com