
科目: 来源: 题型:选择题
| 选项 | 离子组 | 试剂X | 离子方程式 |
| A | Fe3+、Al3+、SiO32-、NO3- | 过量的盐酸 | SiO32-+2H+=H2SiO3↓ |
| B | 透明溶液中:Fe3+、NH4+、SO42-、Cl- | 过量的铜粉 | 2Fe3++Cu=2Fe2++Cu2+ |
| C | Na+、Ba+、HCO3-、Cl- | NaHSO4溶液 | H++HCO3-=CO2↑+H2O |
| D | pH=1的溶液中:Mg2+、Fe2+、NO3-、SO42- | 双氧水 | 2Fe2++H2O2+2H+=2Fe3++2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯和苯使溴水褪色的原因不同 | |
| B. | 苯和氢气在一定条件下生成环己烷的反应为还原反应 | |
| C. | 硝基苯和乙酸乙酯的制备都发生了取代反应 | |
| D. | 由乙醇制取乙烯发生了氧化反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 推广使用煤的液化、气化技术,可有效防治雾霾天气 | |
| B. | 氢氟酸可在玻璃器皿上刻蚀标记 | |
| C. | 高温、紫外线或“84”消毒液均可用于杀菌消毒 | |
| D. | 纯碱可以去除油污是因为Na2CO3可直接与油污反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
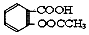 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如图:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如图: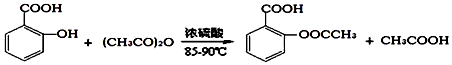
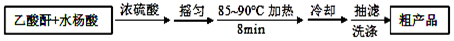
| 名 称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
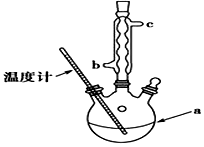
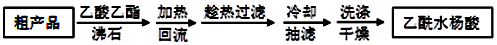
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 《天工开物》中有“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中的矾指的是金属硫化物 | |
| B. | 《黄白第十六》中有“曾青涂铁,铁赤如铜”涉及的反应为置换反应 | |
| C. | 西晋刘琨《重赠卢谌》中的诗句“何意百炼钢,化为绕指柔”中包含有化学变化 | |
| D. | 中国蓝是古代人工合成的蓝色化合物,其化学式为BaCuSi4O10,可改写成BaO•CuO•4SiO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
 |  |  |  |
| 古代与现代的冶金均运用了相同的化学原理 | 古代与现代的火箭发射均利用了液体燃料 | 古代捣碎中药与现代中药纳米粉碎均是化学变化 | 古代风筝与现代热气球飞行均无需物质直接供给能量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
 第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com