
科目: 来源: 题型:推断题
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
| Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
| W | 水解反应 | 无现象 | 无现象 | 无现象 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | NO中氮氧键 | Cl-Cl键 | Cl-N键 | N=O键 |
| 键能/KJ/mol | 630 | 243 | a | 607 |
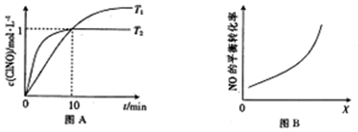
查看答案和解析>>
科目: 来源: 题型:选择题
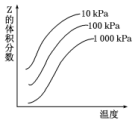 如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )| A. | 恒容时,混合气体的密度可作为此反应是否达到化学平衡状态的判断依据 | |
| B. | X、Y、Z均为气态 | |
| C. | 上述反应的逆反应的△H>0 | |
| D. | 使用催化剂Z的产率提高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10% | B. | 11.1% | C. | 0.1% | D. | 20% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用玻璃棒蘸取NaClO溶液点在干燥的PH试纸上,试纸呈现蓝色,证明HClO是弱酸 | |
| B. | 将一定量的FeCl3晶体、盐酸依次加入容量瓶中,配制一定物质的量浓度的FeCl3溶液 | |
| C. | 为证明Cu与浓硫酸反应生成了CuSO4,可将反应后的混合液冷却后再加入水,若显色即可证明生成了CuSO4 | |
| D. | 用乙醇、乙酸及浓硫酸制取乙酸乙酯的过程中发现忘加碎瓷片,需在完全冷却后再补 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 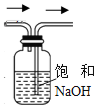 装置可用于除去NO气体中的NO2杂质 | |
| B. |  向图装置的溶液中滴入KSCN溶液不变红色,可以说明铁还没有发生吸氧腐蚀 | |
| C. | 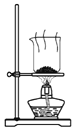 装置用于灼烧碎海带以证明海带中存在I- | |
| D. | 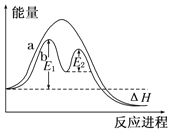 图中的E1可表示有催化剂存在的条件下,对应反应的活化能 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 目的 | 除杂试剂 | 实验方法 |
| A | 除去CuCO3固体中的(NH4)2CO3 | - | 置于坩埚中加热至恒重 |
| B | 除去Ag2S中少量AgCl | Na2S溶液 | 过滤 |
| C | 除去乙稀中的SO2气体 | 酸性高锰酸钾溶液 | 洗气 |
| D | 除去甘油中的乙酸 | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料n | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积/L | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | v甲 | v乙 | v丙 |
| A. | V甲>V乙 | B. | K丙>K乙 | C. | V甲=V丙 | D. | c乙>c甲 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com