
科目: 来源: 题型:解答题
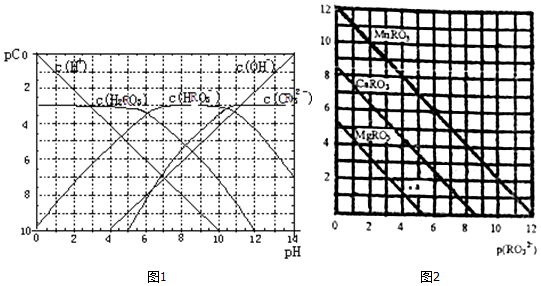
查看答案和解析>>
科目: 来源: 题型:解答题
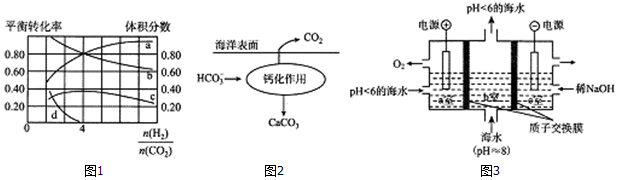
查看答案和解析>>
科目: 来源: 题型:解答题
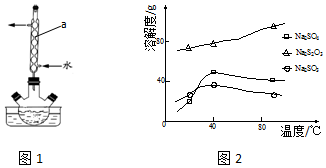
查看答案和解析>>
科目: 来源: 题型:解答题

 同分异构体的结构简式.
同分异构体的结构简式.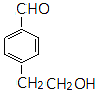 、
、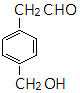 .
.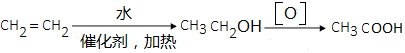 .(无机试剂可以任选)
.(无机试剂可以任选)查看答案和解析>>
科目: 来源: 题型:解答题
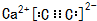 .
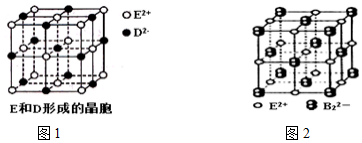
.
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 第一电离能:③>②>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:③>①>② | D. | 最高化合价:②>①>③ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HC1O |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
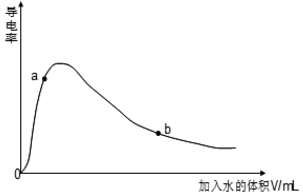
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 35Cl和37Cl的原子结构示意图均为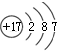 | |
| B. | HCI的形成过程为 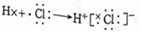 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 草酸的电离过程为H2C2O4?2H++C2O42- |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com