
科目: 来源: 题型:选择题
| A. | 乙酸是非电解质 | |
| B. | 上述制备乙酸的化学方程式为CO2+CH4$\stackrel{Cu_{2}Al_{2}O_{2}}{→}$CH3COOH | |
| C. | 上述制备乙酸的反应中原子利用率为80% | |
| D. | 乙酸没有同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
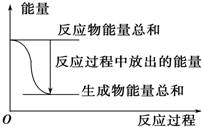
| A. | 其反应物或生成物都能用来表示该反应的速率 | |
| B. | 反应过程中能量关系可用如图表示 | |
| C. | 若将该反应设计成原电池,锌为负极 | |
| D. | 若设计为原电池,当有32.5g锌溶解,标准状况下正极放出11.2L气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用漂白精时滴加少量白醋,可提高漂白精的漂白效率 | |
| B. | 用乙醚从黄花篙的汁液中提取青篙素,应用了蒸馏原理 | |
| C. | 古代染坊常用草木灰浸取液来精炼丝绸,该浸取液的主要成分是烧碱 | |
| D. | “地沟油”可用于炼制航空煤油,因为地沟油经过蒸馏可以得到烃类煤油 |
查看答案和解析>>
科目: 来源: 题型:解答题
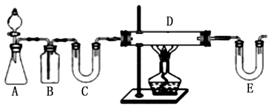

查看答案和解析>>
科目: 来源: 题型:解答题
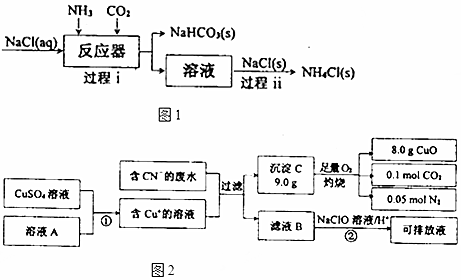
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在标准状况下,11.2LNO与5.6LO2混合后,所含分子数为0.5NA. | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含OH-数为0.1NA | |
| C. | 高温下,16.8g铁与足量水蒸气完全反应失去0.8NA个电子 | |
| D. | 0.1mol NaHSO4晶体中含阳离子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
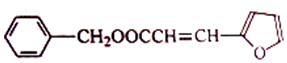 )的合成路线:
)的合成路线: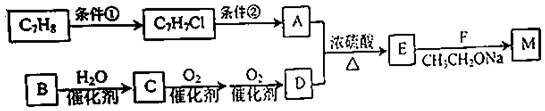
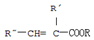
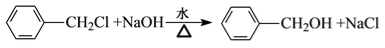 .A+D→E的反应类型为取代反应(酯化反应).
.A+D→E的反应类型为取代反应(酯化反应).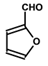 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com