
科目: 来源: 题型:解答题
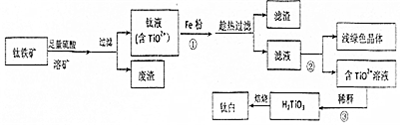
查看答案和解析>>
科目: 来源: 题型:解答题
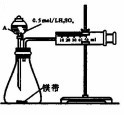 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:| 时间/s | t | 2t | … |
| 活塞的位置/mL | 25.6 | 36.0 | … |
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
查看答案和解析>>
科目: 来源: 题型:实验题
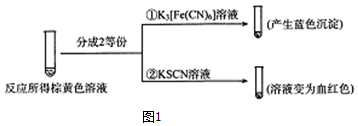
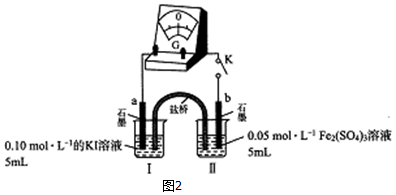
查看答案和解析>>
科目: 来源: 题型:多选题
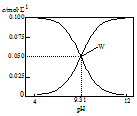
| A. | 将0.1 mol•L-1的HCN溶液和0.1 mol•L-1NaCN溶液等体积混合(忽略溶液体积变化):c(Na+)>c(HCN)>c(CN-)>c(OH-)>c(H+) | |
| B. | W点表示溶液中:c(Na+)+c(H+)=c(HCN) | |
| C. | pH=8的溶液中:c(Na+)+c(H+)+c(HCN)=0.1mol•L-1+c(OH-) | |
| D. | 将0.3 mol•L-1HCN溶液和0.2 mol•L-1NaOH溶液等体积混合(忽略溶液体积变化):c(CN-)+3c(OH-)=2c(HCN)+3c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向氨水中加入碳酸钙固体,溶液pH增大 | |
| B. | 锌的金属活动性比铁强,可在海轮外壳上装上锌块以减缓船体腐蚀 | |
| C. | 需加热才能发生的反应一定是吸热反应 | |
| D. | 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下可自发进行,则该反应的△H>0 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.10 | 0.10 | 0.09 |
| ② | 800 | 0.20 | 0.20 | 0.10 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A. | 实验①中,若5min时测得n(M)=0.05mol,则0至5min时间内,用N表示的平均反应速率v(N)=0.01 mol/( L•min) | |
| B. | 实验②中,该反应的平衡常数K=1.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 实验④中,达到平衡时,b>0.06 |
查看答案和解析>>
科目: 来源: 题型:实验题
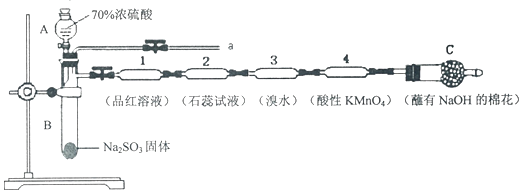
查看答案和解析>>
科目: 来源: 题型:推断题
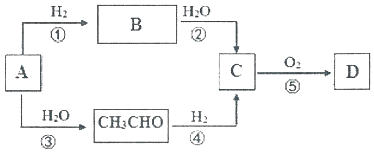
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com