
科目: 来源: 题型:选择题
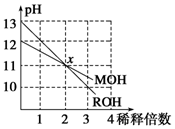 MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )| A. | MOH和ROH都是强碱 | |
| B. | 稀释前,ROH=10MOH | |
| C. | 常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性 | |
| D. | 在x点,M+=R+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 相等 | B. | 前者比后者大3倍 | ||
| C. | 后者是前者的1011倍 | D. | 后者是前者的108倍 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:2 | B. | 4:3 | C. | 2:1 | D. | 3:1 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| C(KI) | V | C(H2SO4) | V | ||||
| 1 | 25℃ | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | l组和2组探究②温度对该反应速率的影响;2组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 35℃ | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 35℃ | 1mol/L | 5mL | ①0.2mol/L硫酸 | 5mL | 3滴 | |
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉溶液,然后逐滴加入1mol/L KOH溶液,观察现象. | 若蓝色不褪色,则假设二正确. |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
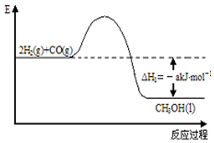 能源是人类生存和发展的重要支柱.研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-b kJ•mol-1,CH3OH的燃烧热
能源是人类生存和发展的重要支柱.研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-b kJ•mol-1,CH3OH的燃烧热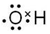 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| B. | 在25℃、101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为-285.8kJ/mol | |
| C. | 在25℃、101kPa时,1molC与适量O2反应生成1molCO其它时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com