
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
 (1)常温下,0.5mol甲醇在氧气中充全燃烧生成CO2和液态水,放出热量363.3kJ.写 出甲醇燃烧的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6kJ•mol-1.
(1)常温下,0.5mol甲醇在氧气中充全燃烧生成CO2和液态水,放出热量363.3kJ.写 出甲醇燃烧的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6kJ•mol-1.查看答案和解析>>
科目: 来源: 题型:实验题
实验 序号 | 时间/min 浓度/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 天然气、酒精分别属于化石能源、可再生能源 | |
| B. | 金属在潮湿空气中生锈,主要是发生析氢腐蚀 | |
| C. | NaClO具有强氧化性,可作织物漂白剂 | |
| D. | 高纯硅广泛应用于太阳能电池和半导体材料的制造 |
查看答案和解析>>
科目: 来源: 题型:选择题
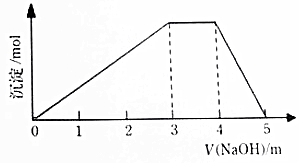 中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )
中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 由R、X、Y、M四种元素只组成一种盐 | |
| D. | 最高价氧化物对应水化物的酸性:M>Z |
查看答案和解析>>
科目: 来源: 题型:选择题
 短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )
短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 最高价氧化物对应水化物的酸性:M>Z | |
| D. | 由R、X、Y、M四种元素只能组成一种盐 |
查看答案和解析>>
科目: 来源: 题型:选择题
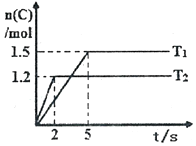 现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )
现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )| A. | T1<T2 | |
| B. | 该反应在温度为T1时达到平衡时,容器中A与C的物质的量浓度相等 | |
| C. | 温度为T2时,2s内B的平均速率为0.3mol•L-1•s-l | |
| D. | 温度为T1时,达平衡时反应物A的转化率为60% |
查看答案和解析>>
科目: 来源: 题型:解答题
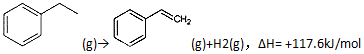
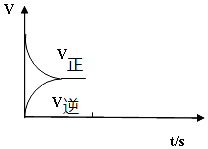
查看答案和解析>>
科目: 来源: 题型:实验题
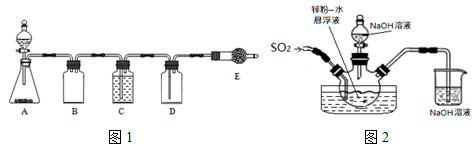
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com