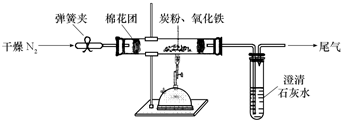
(2009?泰安模拟)为探索工业含铝、铁、铜合金废料的再利用,某同学设计的实验方案如下:

请回答:
(1)操作①用到的玻璃仪器有
烧杯、漏斗、玻璃棒
烧杯、漏斗、玻璃棒
;
(2)写出反应①的化学方程式
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
;
反应②的离子方程式
[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-
[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-
;
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)
取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色
取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色
;
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是
Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O
Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O
;
(5)将滤渣B的均匀混合物平均分成四等份,每份13.2g,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO).
| 实验编号 |
① |
② |
③ |
④ |
| 稀硝酸体积/mL |
100 |
200 |
300 |
400 |
| 剩余金属质量/g |
9.0 |
4.8 |
0 |
0 |
| NO体积/L |
1.12 |
2.24 |
3.36 |
V |
试通过计算填空:
①写出实验①中发生反应的离子方程式
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
;
②实验④中V=
4.48L
4.48L
.


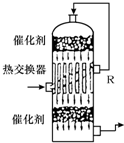 (2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:
(2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题: