
科目: 来源: 题型:选择题
| A. | ③④⑦⑩ | B. | ①③⑥⑧ | C. | ①④⑧⑨ | D. | ②⑤⑦⑨ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 |  | 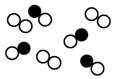 |  |
| A | B | C | D |
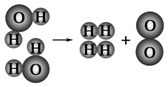
| A | B | C |
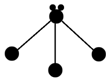 |  | 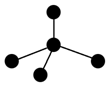 |
| NH3 | CO2 | CCl4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原混合溶液中 c(K+)为 2 mol•L-1 | |
| B. | 电解过程中共转移 8 mol电子 | |
| C. | 电解得到的Cu 的物质的量为 0.5 mol | |
| D. | 电解后溶液中的 c(H+)为 2 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 按系统命名法,化合物 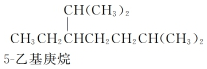 的名称为2,6二甲基5乙基庚烷 的名称为2,6二甲基5乙基庚烷 | |
| B. | 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 | |
| C. | 化合物  是苯的同系物 是苯的同系物 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液的浓度增大 | |
| B. | 溶液的pH增大 | |
| C. | 溶液中钠离子与碳酸根离子的物质的量之比变小 | |
| D. | 溶液的质量分数不变 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100ml 0.1mol/L的氯水中通入0.01molSO2气体 | |
| B. | 100ml 0.5mol/L的NaOH中通入0.005mol氯气 | |
| C. | 100ml 0.5mol/L的CuSO4溶液中加入4g NaOH固体 | |
| D. | 100ml自来水中加入0.01mol蔗糖溶解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe(OH)3═Fe3++3OH- | B. | KHSO4?K++H++SO42- | ||
| C. | NH4HCO3═NH4++HCO3- | D. | NaH2PO4═Na++2H++PO43- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com