
科目: 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0 则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol 则H2的燃烧热为285.8 kJ/mol | |
| C. | 已知2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol 则C(碳)的燃烧热为110.5 kJ/mol | |
| D. | 已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol 则该反应的中和热为114.6 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
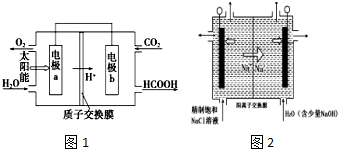 碳及其化合物与人类的生活、生产紧密联系.
碳及其化合物与人类的生活、生产紧密联系.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有等物质的量的AlO2-,OH-,CO32-的溶液中逐滴加入盐酸:AlO2-,OH-,CO32- | |
| B. | 含有等物质的量的FeBr2和FeI2溶液中缓缓通入Cl2:I-,Br-,Fe2+ | |
| C. | 在等物质的量的Ba(OH)2和KOH溶液中缓缓通入CO2:KOH,Ba(OH)2,BaCO3 | |
| D. | 在含有等物质的量的Fe3+、Ag+、Cu2+、H+、Fe2+的溶液中逐渐加入锌粉:Ag+、Fe3+、Cu2+、H+、Fe2+ |
查看答案和解析>>
科目: 来源: 题型:推断题
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10% | B. | 30% | C. | 50% | D. | 70% |
查看答案和解析>>
科目: 来源: 题型:选择题
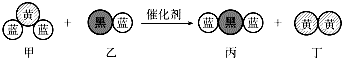
| A. | 若蓝、黑球原子的相对质量之比为4:3,则乙、丙两物质的摩尔质量之比为7:11 | |
| B. | 若乙丙中蓝球元素显相同负价,则乙中黑球元素失去电子,被氧化 | |
| C. | 若甲中黄球元素显正价,则丁为还原产物 | |
| D. | 化学方程式中乙、丁的化学计量数均为1 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单氢化物的稳定性X<Z<W | |
| B. | Y单质在一定条件下可以与氧化铁发生置换反应 | |
| C. | X、Y、W最高价氧化物的水化物两两之间能发生反应 | |
| D. | 室温下,0.1mol/L W的气态氢化物的水溶液的pH>1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com