
科目: 来源: 题型:选择题
| A. | 与铝反应放出H2的溶液Na+、NH4+、Cl?、NO3- | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42-、I? | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl?、HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若某反应的生成物总能量低于反应物总能量,则该反应为吸热反应 | |
| B. | 若A2+2D-=2A-+D2,则氧化性:D2>A2 | |
| C. | 若R2-和M+的电子层结构相同,则原子序数:R>M | |
| D. | 若甲、乙两种有机物具有相同的分子式,不同的结构,则甲和乙一定是同分异构体 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
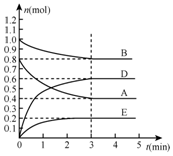 在某个容积为2L的密闭容器内,在T℃时按下图1所示发生反应:mA(g)+nB(g)?pC(g)+qE(s),△H<0(m、n、p、q为最简比例的整数).
在某个容积为2L的密闭容器内,在T℃时按下图1所示发生反应:mA(g)+nB(g)?pC(g)+qE(s),△H<0(m、n、p、q为最简比例的整数).查看答案和解析>>
科目: 来源: 题型:选择题
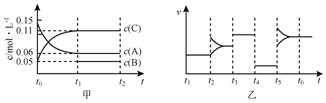
| A. | 若t1=15s,生成物C在t0~t1时间段的平均反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件为降低反应温度 | |
| C. | B的起始物质的量为0.02mol | |
| D. | t5~t6阶段容器内A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=-100akJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:填空题
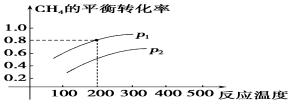
查看答案和解析>>
科目: 来源: 题型:推断题
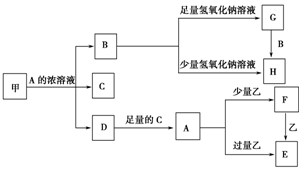 中学化学中常见的几种物质存在如图关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体.(图中部分产物和反应条件已略去)
中学化学中常见的几种物质存在如图关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体.(图中部分产物和反应条件已略去)查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com