
科目: 来源: 题型:解答题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| CaO2平均生成速率(×10-3mol.s-1) | 7.5 | 8.2 | 9.4 | 8.0 | 7.1 | 6.7 | 5.5 |
| t/min | 0 | 10 | 20 | 30 | 40 |
| φ(CO) | 0.250 | 0.235 | 0.225 | 0.200 | 0.200 |
查看答案和解析>>
科目: 来源: 题型:推断题
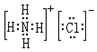 ,其中存在的化学键类型为离子键和共价键.
,其中存在的化学键类型为离子键和共价键. ;元素D最高价氧化物的水化物的化学式为H3PO4或HPO3.
;元素D最高价氧化物的水化物的化学式为H3PO4或HPO3.查看答案和解析>>
科目: 来源: 题型:解答题
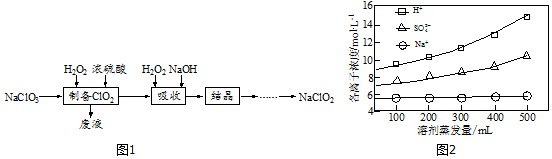
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  装置中阴极上析出红色固体 | |
| B. | 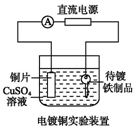 装置的待镀铁制品应与电源负极相连 | |
| C. | 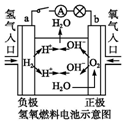 装置闭合电键后,外电路电子由a极流向b极 | |
| D. | 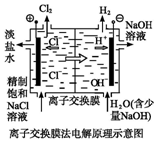 装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
查看答案和解析>>
科目: 来源: 题型:选择题
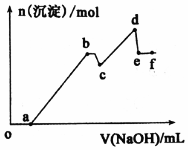 已知25℃时,Ksp[Mg(OH)2]=5.61×l0-12,Ksp[Al(OH)3]=1.3×l0-33,Al(OH)3?AlO2-+H++H2O Ka=6.31×l0-13.某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子.向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关说法正确的是( )
已知25℃时,Ksp[Mg(OH)2]=5.61×l0-12,Ksp[Al(OH)3]=1.3×l0-33,Al(OH)3?AlO2-+H++H2O Ka=6.31×l0-13.某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子.向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关说法正确的是( )| A. | b 点沉淀-Al(OH)3;d 点沉淀-A1(OH)3和Mg(OH)2;e点溶质-NaA1O2 | |
| B. | 依据题意,用NaOH不能完全分离Mg2+和Al3+离子 | |
| C. | cd 段发生的反应为:Mg2++2OH-=Mg(OH)2↓ | |
| D. | bc 段发生的反应为:Al(OH)3+OH-=A1O2-+2H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
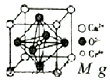 铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是:
铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是: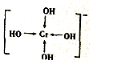 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味.工业上,提纯粗硅的原理如下:粗硅$→_{△}^{HCl}$SiCl4$→_{△}^{Si+H_{2}}$SiHCl3$→_{△}^{H_{2}}$Si(纯)
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味.工业上,提纯粗硅的原理如下:粗硅$→_{△}^{HCl}$SiCl4$→_{△}^{Si+H_{2}}$SiHCl3$→_{△}^{H_{2}}$Si(纯)查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com