
科目: 来源: 题型:实验题
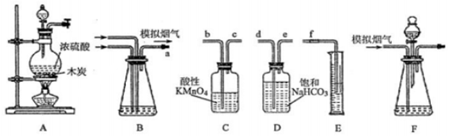
查看答案和解析>>
科目: 来源: 题型:解答题
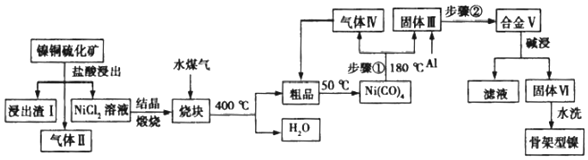
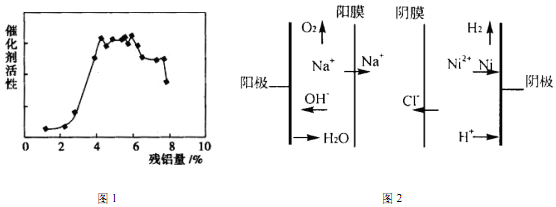
查看答案和解析>>
科目: 来源: 题型:实验题
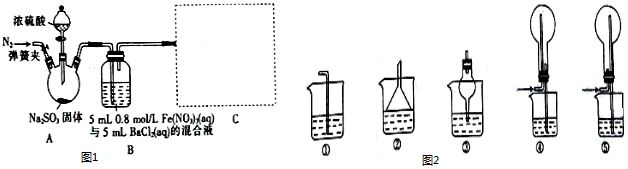
查看答案和解析>>
科目: 来源: 题型:实验题
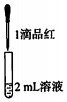 | 试管中的溶液 | 现象 |
| a.0.1mol/LSO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
| b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
| c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
| d.pH=10NaOH溶液 | 红色溶液不变色 | |
| e.pH=2H2SO4溶液 | 红色溶液不变色 |
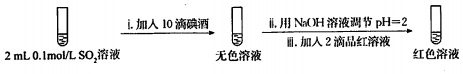
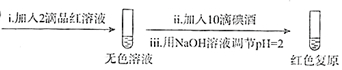
查看答案和解析>>
科目: 来源: 题型:解答题

 +R3
+R3 $\stackrel{C_{2}H_{5}ONa}{→}$
$\stackrel{C_{2}H_{5}ONa}{→}$ +R2OH
+R2OH .
. .
.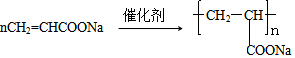 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 12753I和13153I是质子数相同的同种核素 | |
| B. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,所以NH3沸点低于PH3 | |
| C. | 实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| D. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 叙述I | 叙述II |
| A.NH4Cl受热易分解 | 可用加热法除去I2中的NH4Cl |
| B.往氯化钙溶液中通入足量的CO2 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C.水玻璃具有黏性 | 盛装烧碱溶液的试剂瓶不能用玻璃塞 |
| D.利用丁达尔现象区分氢氧化铁胶体和浓的氯化铁溶液 | 往氢氧化钠溶液中滴加饱和氯化铁溶液,加热至红褐色制得胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| 氧 | X |
| Y | Z |
| 数据编号 | 滴入NaOH溶液的体积/mL | 溶液pH | |
| HX | HZ | ||
| ① | 0 | 3 | 1 |
| ② | 20.00 | a | 7 |
| A. | 表格中a<7 | |
| B. | HX和HZ等体积混合后pH=1+lg2 | |
| C. | Y和Z两元素的简单氢化物受热分解,前者分解温度高 | |
| D. | 0.l000 mol/L Na2Y的水溶液中:c(Y2-)+c(HY-)+c(H2Y)=0.1000 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com