
科目: 来源: 题型:选择题
| A. | 向Na[Al(OH)4]溶液中通入足量CO2:2[Al(OH)4]-+CO2═2Al(OH)3↓+CO32-+H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| C. | 铜和氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硝基苯中混有浓硝酸,加入足量稀NaOH溶液洗涤,振荡,用分液漏斗分液 | |
| B. | 乙烯中混有SO2、CO2,将其通入NaOH溶液洗气 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶 | |
| D. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯中加入溴水后溴水层颜色变浅,这是由于发生了取代反应 | |
| B. | 乙烯和苯分子中所有原子在同一平面上 | |
| C. | 一氯丙烷(C3H7Cl)的同分异构体共有3种 | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
 ,COCl2分子内含有D(填标号);
,COCl2分子内含有D(填标号); ,其中C原子采用的轨道杂化方式有sp2、sp3.
,其中C原子采用的轨道杂化方式有sp2、sp3.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{Ba(NO_{3})_{2}}{→}$BaSO4 | |
| B. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| C. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{电解}{→}$Mg | |
| D. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题

 $→_{②H+}^{①浓KOH、△}$
$→_{②H+}^{①浓KOH、△}$ +
+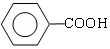
 .
. ,该反应的反应类型是缩聚反应.
,该反应的反应类型是缩聚反应. +4Ag(NH3)2++4OH-$\stackrel{△}{→}$
+4Ag(NH3)2++4OH-$\stackrel{△}{→}$ +2NH4++6NH3+4Ag↓+2H2O.
+2NH4++6NH3+4Ag↓+2H2O. 中任意一种.
中任意一种. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=9.25、浓度均为0.1 mol•L-1的NH4C1、NH3•H2O混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| B. | 0.1mol/LH2SO4溶液与0.1mol/LNaOH溶液等体积混合:c(H+)═c(SO42-)+c(OH-) | |
| C. | 向0.10mol•L-1NaHSO3溶液中通NH3至pH=7:c(Na+)>c(SO32-)>c(NH4+) | |
| D. | CO2通入KOH溶液,当由水电离的H+浓度为10-7mol/L,一定存在:c(K+)=2c(CO32-)+c(HCO3-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com