
科目: 来源: 题型:选择题
| A. | 质量数为31的磷原子:3115P | B. | 氟原子的结构示意图: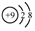 | ||
| C. | CaCl2的电子式: | D. | 明矾的化学式:Al2(SO4)3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 夏天设定空调温度尽可能的低 | B. | 推广使用一次性塑料袋和纸巾 | ||
| C. | 少开私家车多乘公共交通工具 | D. | 对商品进行豪华包装促进销售 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
查看答案和解析>>
科目: 来源: 题型:解答题
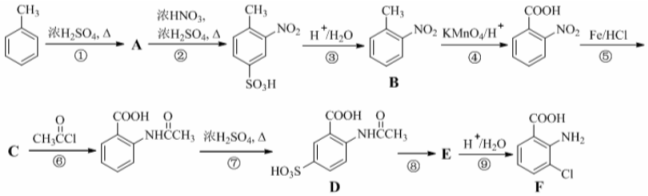

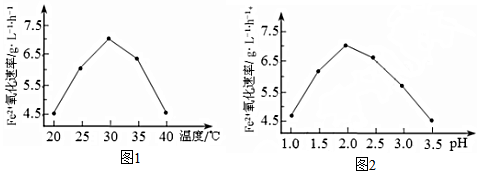
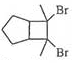
 分子中不同化学环境的氢原子共有4种,共面原子数目最多为13.
分子中不同化学环境的氢原子共有4种,共面原子数目最多为13.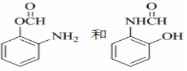 .
. ,该步反应的主要目的是保护氨基.
,该步反应的主要目的是保护氨基.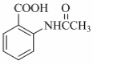 为主要原料,经最少步骤制备含肽键聚合物的流程.
为主要原料,经最少步骤制备含肽键聚合物的流程.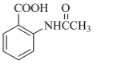 …$→_{反应条件}^{反应试剂}$目标化合物 …$→_{反应条件}^{反应试剂}$目标化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较3 0min时变浅 |
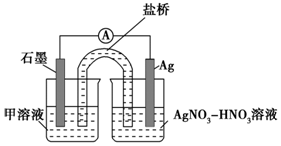
查看答案和解析>>
科目: 来源: 题型:解答题
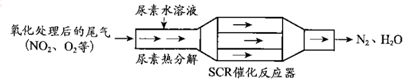
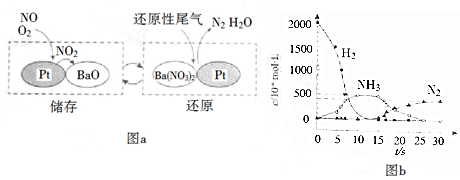
查看答案和解析>>
科目: 来源: 题型:解答题
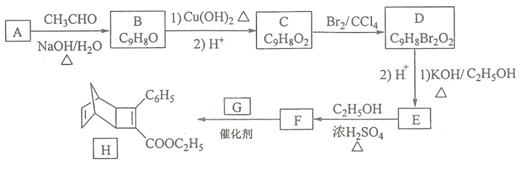
 +
+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$
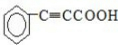 .
.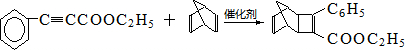 .
.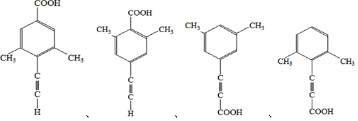 .
. 的合成路线
的合成路线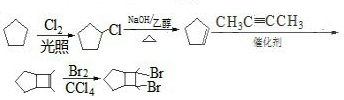 (其他试剂任选).
(其他试剂任选).查看答案和解析>>
科目: 来源: 题型:解答题
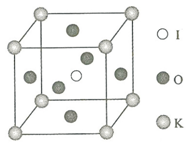 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com