
科目: 来源: 题型:选择题
| A. | W的最高价氧化物能与水反应生成相应的酸 | |
| B. | 室温下,0.05mol•L-1的M的气态氢化物的水溶液的PH>l | |
| C. | 简单离子半径由大到小的顺序:Y>Z>M | |
| D. | Y、Z元素的单质作电极,在NaOH溶液环境下构成原电池,Z电极上产生大量气泡 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| B. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| C. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| D. | “酸坏之酒皆可蒸烧,复烧二次价值数倍也”.该方法也可以分离乙酸和乙酸乙酯 |
查看答案和解析>>
科目: 来源: 题型:解答题
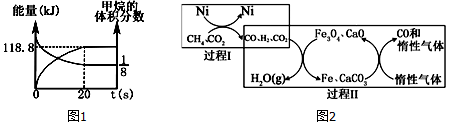
查看答案和解析>>
科目: 来源: 题型:解答题
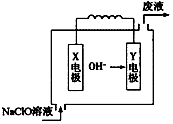 镁是一种重要的金属资源,在各领域都具有重要的作用.
镁是一种重要的金属资源,在各领域都具有重要的作用.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Y的最高价氧化物对应水化物的碱性比Z的弱 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | Y3W与YW3中的化学键类型相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
 A.2SO2(g)+O2(g)?2SO3(g)△H<0 |  B.25℃时,用0.1mol/L盐酸滴定20mL0.1mol/LNaOH溶液 |
 C.酸性KmnO4溶于与过量的H2C2O4溶液混合 |  D.CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0,使用催化剂(a)和未使用催化剂(b) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:W<X<Y<Z | |
| B. | 1mol简单氢化物分别溶于等体积的水中形成体系的pH:Z>Y>X | |
| C. | W与X或Y都能形成既含极性键,又含非极性键的化合物 | |
| D. | 在化合物A的分解反应中丙为氧化产物,丁为还原产物 |
查看答案和解析>>
科目: 来源: 题型:选择题
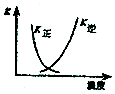
 电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O=1.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O=1.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定二甲胺溶液的曲线 | |
| B. | a点溶液与d点的溶液混合后的溶液中:c[(CH3)2NH2+)]<c[(CH3)2NH•H2O] | |
| C. | d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH•H2O] | |
| D. | b、c、e三点的溶液中,水的电离程度最大的是b点 |
查看答案和解析>>
科目: 来源: 题型:选择题
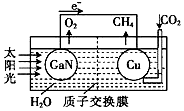 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 为提高该人工光合系统的工作效率,可向装置中加入少量盐酸 | |
| B. | Cu电极上的电极反应为CO2+8e-+8H+=CH4+2H2O | |
| C. | H+从左池移向右池 | |
| D. | 当装置中有1mol CH4生成时,GaN电极有44.8LO2生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
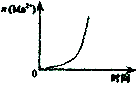
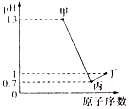 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )| A. | 简单阴离子的还原性:Z<W | |
| B. | Y、Z的简单离子都会影响水的电离平衡 | |
| C. | 乙固体中加入甲的溶液或浓氨水,固体都能溶解 | |
| D. | X、Y分别与W形成的化合物皆为离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com