
科目: 来源: 题型:选择题
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.20mol | B. | 0.40mol | C. | 0.42mol | D. | 0.60m |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化性强弱:F2>Cl2>Br2 | B. | 非金属性:O>S>Se | ||
| C. | 还原性强弱:F->Cl->I- | D. | 碱性强弱:KOH>NaOH>LiOH |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
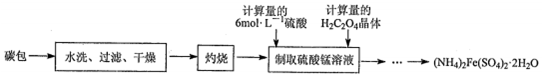
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
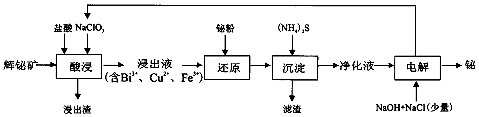
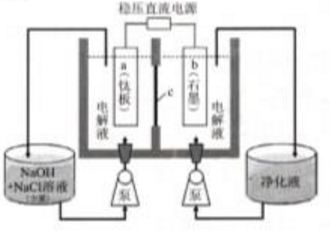
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100℃纯水的pH<7,此时水仍呈中性 | |
| B. | pH=3的醋酸溶液,稀释至100倍后pH小于5 | |
| C. | 0.2 mol/L的盐酸,与等体积水混合后pH=1 | |
| D. | pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 引发该反应一定需要加热或点燃等条件 | |
| B. | E1逆反应的活化能,E2是正反应的活化能 | |
| C. | 催化剂能减小E1和E2,但不改变反应的焓变 | |
| D. | X、Y、Z表示的反应速率之比为2:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com