
科目: 来源: 题型:选择题
| A. | 32gCu在足量O2或硫蒸气中完全燃烧失去的电子数均为NA | |
| B. | 4g甲烷和8g甲醇含有的氢原子数均为NA | |
| C. | 标准状况下,5.6L乙烷中含有的共价键数目为1.5NA | |
| D. | 一定条件下,32gSO2与足量O2反应,转移电子数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学性质 | 应用 | |
| A | O价铁具有还原性 | 铁粉可用于食品中的脱氧剂 |
| B | 明矾与NaOH生成Al(OH)3 | 明矾可作净水剂 |
| C | Fe的金属性比Cu活泼 | FeCl3浓溶液腐蚀Cu刻制印刷电路板 |
| D | NaHCO3水解显碱性 | 发酵粉中含有NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验操作 | 实验现象 | 实验目的 | |
| A | 向待测液中滴加盐酸和稀硝酸 | 产生白色沉淀 | 检验待测液中是否含有Ag+ |
| B | 将含有少量CO2的CO气体緩缓通过足量的 过氧化钠粉末 | 淡黄色粉末变白 | 除去CO2,提纯CO |
| C | 在Na2S溶液中滴加新制氯水 | 产生浅黄色沉淀 | 证明氯的非金属性比硫的强 |
| D | 在Ag2S浊液中滴加NaCl溶液 | 产生白色沉淀 | 比较Ag2S和AgCl的溶解度大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 28 g乙烯和甲烷混合气体中的氢原子数为4NA | |
| B. | 标准状况下,11.2 LCH2Cl2含有的共价键数为2NA | |
| C. | 1mol SO2与 l mol O2反应生成的SO3分子数为NA | |
| D. | 过量铜与含0.4 molHNO3的浓硝酸反应,电子转移数大于0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碘酒能使蛋白质变性,涂在人体皮肤上可杀菌消毒 | |
| B. | 大米、小米、马铃薯中均含有淀粉,可为人体活动提供能量 | |
| C. | 食盐、糖、醋可作调味剂,不可用作食品防腐剂 | |
| D. | 船帕外壳装上锌块防腐,采用的是牺牲阳极的阴极保护法 |
查看答案和解析>>
科目: 来源: 题型:实验题
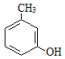 +CH3COCH2COOC2H5$→_{10℃搅拌12h}^{浓硫酸}$
+CH3COCH2COOC2H5$→_{10℃搅拌12h}^{浓硫酸}$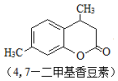 +C2H5OH+H2O
+C2H5OH+H2O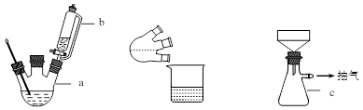
查看答案和解析>>
科目: 来源: 题型:实验题
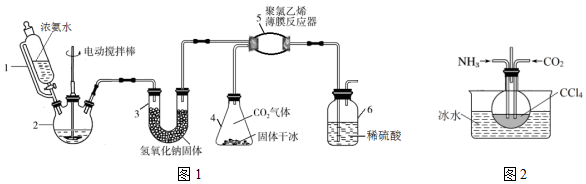
查看答案和解析>>
科目: 来源: 题型:解答题
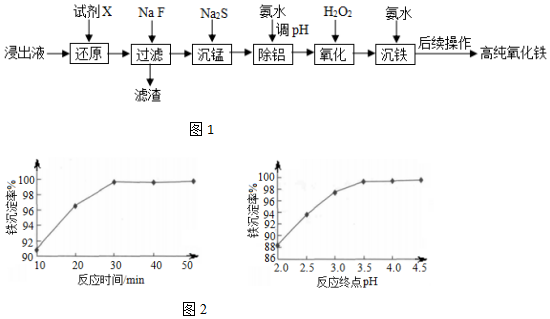
| 氢氧化物 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 |
| 沉淀完全的pH | 3.2 | 8.8 | 5.0 |
查看答案和解析>>
科目: 来源: 题型:选择题
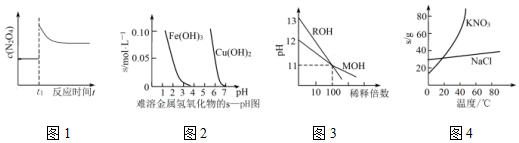
| A. | 图1表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 | |
| B. | 图2表示除去CuSO4溶液中的Fe3+可采用加入CuO调节溶液pH到4~5 | |
| C. | 图3表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,则碱性:MOH>ROH | |
| D. | 图4为KNO3和NaCl溶解度曲线,若除去NaCl中少量的KNO3,可在较高温度下制得浓溶液后,再冷却结晶、过滤、洗涤、干燥得纯净NaCl |
查看答案和解析>>
科目: 来源: 题型:选择题
 化学上常用AG表示溶液中的lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.25℃时,用0.100mol•L-1的NaOH溶液滴定20.00mL 0.100mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
化学上常用AG表示溶液中的lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.25℃时,用0.100mol•L-1的NaOH溶液滴定20.00mL 0.100mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A. | D点溶液的pH=11.25 | |
| B. | B点溶液中存在 c(H+ )-c(OH- )=c(NO2- )-c(HNO2) | |
| C. | C点时,加入NaOH溶液的体积为20 mL | |
| D. | 25℃时,HNO2的电离常数Ka=1.0×10-55 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com