
科目: 来源: 题型:解答题
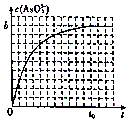 砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题:
砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:解答题

| 装置质量 | 实验前/g | 实验后/g |
| B | 22.6 | 42.4 |
| E(不含干燥管) | 80.2 | 146.2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水,若电路中通过NA个电子,则阴极一定产生11.2LCl2 (标况) | |
| B. | lmolCH3COOC2H5在稀硫酸溶液中受热水解可得到乙醇分子数为NA | |
| C. | 含NA个Na+的Na2O2溶解于水配成2L溶液,所得溶液中Na+的物质的量浓度为0.5mol/L | |
| D. | 足量的MnO2固体与1L12mol/L的浓盐酸加热时反应,生成Cl2的分子数为3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 磷及其化合物在生产生活中的用途非常广泛.回答下列问题:
磷及其化合物在生产生活中的用途非常广泛.回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题

| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b之间用电流计连接时,指针不会发生偏转 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HNO3为电解质溶液 | B. | 锌为原电池正极 | ||
| C. | 锌极质量不变 | D. | 铜为原电池正极 |
查看答案和解析>>
科目: 来源: 题型:实验题

| 实验步骤 | 实验操作 | 现象 | 实验结论 |
| 1 | ① | ② | NaNO2具有氧化性 |
| 2 | ③ | ④ | NaNO2具有还原性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 充电时电池反应式为FePO4+Li═LiFePO4 | |
| B. | 放电时在正极上是Li+得电子被还原 | |
| C. | 放电时电池内部Li+向正极移动 | |
| D. | 充电时动力电池上“+”的电极与外接电源的负极相连 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若将该反应设计成原电池,反应时化学能转化为电能 | |
| B. | △H的值与反应方程式的化学计量数有关 | |
| C. | 若将该反应设计成原电池,铁棒为负极 | |
| D. | 若将其设计为原电池,当有28gFe溶解时,正极放出气体的体积11.2 L |
查看答案和解析>>
科目: 来源: 题型:选择题
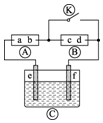 如图为直流电源,?为浸透饱和碘化钾溶液和淀粉溶液的滤纸,?为电镀槽.接通电路后发现?上的d点显蓝色.为实现铁上镀锌,接通
如图为直流电源,?为浸透饱和碘化钾溶液和淀粉溶液的滤纸,?为电镀槽.接通电路后发现?上的d点显蓝色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述不正确的是( )
后,使c、d两点短路.下列叙述不正确的是( )| A. | f电极为锌板 | B. | c极发生的反应为2H++2e-═H2↑ | ||
| C. | a为直流电源的正极 | D. | e极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com