
科目: 来源: 题型:选择题
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.3 mo/L | D. | 0.4 mo/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| B. | 为检验红砖中铁的价态,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液变为红色,说明红砖中只有三氧化二铁 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 将(NH4)2Fe(SO4)2•6H2O试样溶于稀硝酸中,滴加KSCN溶液,出现血红色,说明检验前该试样已变质 |
查看答案和解析>>
科目: 来源: 题型:解答题
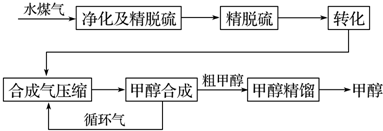
| 物质 | H2 | CO | CH3OH |
| 浓度/mol•L-1 | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 化学事实 | 类推结论 |
| A | Al在O2中燃烧生成Al2O3 | Fe在O2中燃烧也生成Fe2O3 |
| B | 用分别蘸取了浓盐酸和浓氨水的两根玻璃棒相互靠近不接触,可看到白烟 | 用分别蘸取了浓硫酸和浓氨水的两根玻璃棒相互靠近不接触,可以看到白烟 |
| C | 电解熔融MgCl2的方法冶炼金属镁 | 电解熔融NaCl的方法制取金属钠 |
| D | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
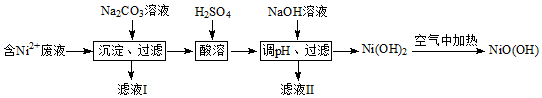
查看答案和解析>>
科目: 来源: 题型:解答题
 化学反应速率和限度与生产、生活密切相关.
化学反应速率和限度与生产、生活密切相关.| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 钌催化剂能加快该反应的速率 | B. | 升高温度能减慢该反应的速率 | ||
| C. | 达到平衡时,CO2能100%转化为CH4 | D. | 达到平衡时,反应速率:v(正)=v(逆)≠0 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 锌片为正极 | |
| B. | 该电池工作时电能转化为化学能 | |
| C. | 该电池的总反应为Zn+2H+═Zn2++H2↑ | |
| D. | 电子由铜片通过导线流向锌片 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用氨水溶解氯化银沉淀:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| B. | Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-═Mg CO3↓+CO32-+2H2O | |
| C. | Na2O2固体投入H218O中:2H218O+2Na2O2=4Na++4OH-+18O2↑ | |
| D. | 苯酚钠溶液跟AlCl3溶液反应:3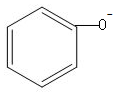 +Al3++3H2O→ +Al3++3H2O→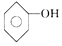 +Al(OH)3↓ +Al(OH)3↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在银氨溶液中可大量含有:Cu2+、K+、Cl-、SO42- | |
| B. | 使甲基橙试液变红色的溶液中可大量含有:K+,Na+,S2-,SO32- | |
| C. | 室温下,pH=12的碱性溶液中一定没有CH3COOH分子 | |
| D. | 在c(H+)=10-14mol/L的溶液中可大量含有:Na+,AlO2-,CO32-,SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com