
科目: 来源: 题型:选择题
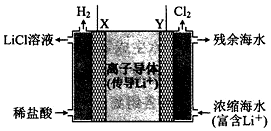 浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )
浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )| A. | 电池工作时,Li+通过离子电子导体移向b区 | |
| B. | 电流由X极通过外电路移向Y极 | |
| C. | 正极发生的反应为:2H++2e-=H2↑ | |
| D. | Y极每生成1 mol Cl2,a区得到2 mol LiCl |
查看答案和解析>>
科目: 来源: 题型:解答题
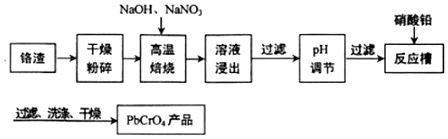
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe2O3 | B. | Fe3O4 | C. | Fe4O5 | D. | Fe6O7 |
查看答案和解析>>
科目: 来源: 题型:解答题
 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.查看答案和解析>>
科目: 来源: 题型:选择题
 在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )
在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )| A. | △H>0 | B. | AB一定是气体物质 | ||
| C. | 反应温度a低于b | D. | A2、B2中最少有一种是气态物质 |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知:
已知:| A. | 反应①使用催化剂,△H1减小 | |
| B. | 反应②生成物总能量低于反应物总能量 | |
| C. | 反应③一定能自发进行 | |
| D. | 反应③达到平衡后升高温度,v(正)、v(逆)的变化如图所示 |
查看答案和解析>>
科目: 来源: 题型:解答题
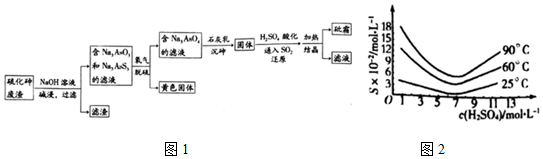
查看答案和解析>>
科目: 来源: 题型:选择题
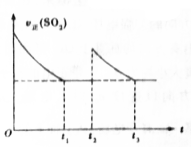 一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.测得v正(SO2)随反应时间(t)的变化如图所示.下列有关说法正确的是( )
一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.测得v正(SO2)随反应时间(t)的变化如图所示.下列有关说法正确的是( )| A. | t2时改变的条件是:只加入一定量的SO2 | |
| B. | t1时平衡常数K1大于t3时平衡常数K2 | |
| C. | t1时平衡混合气的$\overline{{M}_{1}}$大于t3时平衡混合气的$\overline{{M}_{2}}$ | |
| D. | t1时平衡混合气中的SO3的体积分数等于t3时平衡混合气中SO3的体积分数 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com