
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 装置甲中铜片表面产生气泡 | |
| B. | 装置甲中正极的电极反应式:2H++2eˉ=H2↑ | |
| C. | 装置乙中电流从铜片经导线流向锌片 | |
| D. | 装置乙溶液中SO42ˉ向铜片做定向移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 任何化学反应都能设计成原电池 | |
| B. | 手机上用的锂离子电池属于一次电池 | |
| C. | 原电池中的阳离子向负极移动 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,14 g丙烯和环丙烷混合气体中碳原子数为NA | |
| B. | 标准状况下,11.2 L乙烷含有共价键数为3NA | |
| C. | 密闭容器中充入1 mol I2(g)和2 mol H2(g)充分反应,生成HI分子数为2NA | |
| D. | Na2O2与CO2反应时,生成0.5 mol O2转移的电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同 | |
| B. | 制作烟花的过程中常加入金属发光剂和发色剂使烟花放出五彩缤纷的颜色 | |
| C. | 草莓棚中使用的“吊袋式二氧化碳气肥”的主要成分可以是碳酸钙 | |
| D. | 芒硝晶体(Na2SO4•10H2O)白天在阳光下曝晒后失水、溶解吸热,晚上重新结晶放热,实现了太阳能转化为化学能继而转化为热能 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 L 0.5 mol/L NaHCO3溶液中含有的HCO3-数目小于0.5 NA | |
| B. | 11.2 g 铁粉与硝酸反应失去电子数一定为0.6 NA | |
| C. | 25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2 NA | |
| D. | 46 g甲苯含有C=C双键的数目为1.5 NA |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 0.4mol AgNO3受热完全分解(2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑),用排水法最终收集到气体的分子数为0.2NA | |
| B. | 6.4g CaC2中含有的离子总数目为0.3NA | |
| C. | 1 mol FeI2与一定量氯气反应时,若已知有1mol Fe2+被氧化则转移的电子数为3NA | |
| D. | 1mol 苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
查看答案和解析>>
科目: 来源: 题型:解答题
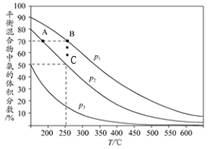 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com