
科目: 来源: 题型:选择题
| A. | 焚烧废旧塑料以防止“白色污染” | |
| B. | 大量CO2排放可导致酸雨的形成 | |
| C. | 积极开发风力、太阳能发电,改善能源结构 | |
| D. | 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐 |
查看答案和解析>>
科目: 来源: 题型:选择题
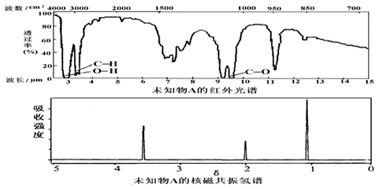
| A. | 由红光外谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子 | |
| C. | 若A的化学式为C3H6O,则其结构简式为CH3COCH3 | |
| D. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子化合物中一定含有金属阳离子和阴离子 | |
| B. | 离子键是阴、阳离子通过静电作用形成的,NaCl熔化时破坏了离子键 | |
| C. | N2分子中含有的共价键很强,故N2分子比较稳定 | |
| D. | 共价键既可存在于共价化合物中,也可存在于离子化合物或非金属单质中 |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图是元素周期表的一部分:
如图是元素周期表的一部分:| 数据编号 | 滴入NaOH溶液的体积/mL | 溶液的pH | |
| HX | HZ | ||
| 1 | 0 | 3 | 1 |
| 2 | 20.00 | a | b |
| A. | 通过分析可得表格中a<7,b=7 | |
| B. | 将上述的HZ溶液稀释100倍后pH比HX溶液的pH大 | |
| C. | 由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强 | |
| D. | 0.l000 mol•L-1 Na2Y的水溶液中:c(Y2-)+c(HY-)+c(H2Y)=0.1000 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
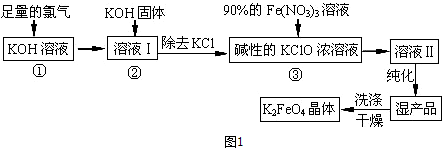
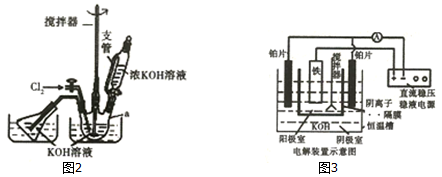
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题

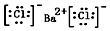 .
.| AgCl | AgI | Ag2CrO4 | |
| Ksp | 2×10-10 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白 | 黄 | 砖红 |
查看答案和解析>>
科目: 来源: 题型:实验题

| 物质 | 熔点 | 沸点 | 水反应性 |
| SiCl4 | -70℃ | 57.6℃ | 强烈水解 |
| CCl4 | -22.9℃ | 76.8℃ | 稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com