
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 如图为浓硫酸与铜片反应的装置.请回答:
如图为浓硫酸与铜片反应的装置.请回答:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ①② | D. | ①③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4LCl2与足量的铁粉反应,转移的电子数为3NA | |
| B. | 含23g钠元素的Na2O和Na2O2混合物中阴离子数目介于0.5NA和NA之间 | |
| C. | 在0℃、101kPa条件下,11.2L丁烷中含极性共价键数目为5NA | |
| D. | 5NH4NO3$\frac{\underline{\;△\;}}{\;}$4N2↑+2HNO3+9H2O中氧化产物比还原产物每多14g,转移电子数为15NA |
查看答案和解析>>
科目: 来源: 题型:解答题
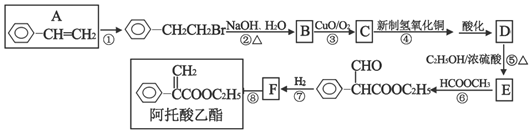
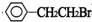 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$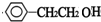 +NaBr.反应③的方程式
+NaBr.反应③的方程式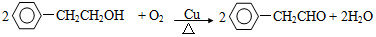 .
.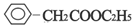 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| B. | 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 | |
| C. | 氨水应密闭保存,置低温处 | |
| D. | 二氧化氮与四氧化二氮的平衡体系,加压后颜色立即变深 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | CO2 晶胞如图1所示,一个CO2 分子周围有12个CO2 分子紧邻 | |
| B. | 由E原子和F原子构成的气态团簇分子模型如图2所示,其分子式为EF或FE | |
| C. | H原子的电子云图如图3所示,H原子核外的大多数电子在原子核附近运动 | |
| D. | 金属Cu原子堆积模型如图4所示,该金属晶体为六方最密堆积,Cu原子的配位数为12 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,pH=l的盐酸溶液中,由水电离出的H+个数为10-13NA | |
| B. | 电解精炼铜时转移了NA个电子,阳极溶解 32 g铜 | |
| C. | 12.4 g白磷(P4)晶体中含有的P-P键数是0.4NA | |
| D. | 1.8g18O2分子与1.8g18O3分子中含有的氧原子数均为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com