
科目: 来源: 题型:选择题
| A. | 反应①属于非氧化还原反应 | |
| B. | 反应②属于非氧化迩原友应 | |
| C. | 反应④中TiO2是氧化剂 | |
| D. | 反应⑤表现了金属镁还原性比进士钛强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO42-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| C. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO3-)+2c(H2CO3)+2c(CO32-) | |
| D. | pH=1的NaHSO4溶液:c(H+)═2c(SO42-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氨水和氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| C. | 0.1mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 常温常压下,6.4gSO2含有的氧原子数为0.2NA | |
| B. | 标准状况下,22.4LCCl4分子中氯原子数为4NA | |
| C. | 2L0.1mol•L-1Na2SO4溶液中含Na+离子数为0.4NA个 | |
| D. | 2.7g金属铝与足量稀硫酸反应生成H2分子数为NA个 |
查看答案和解析>>
科目: 来源: 题型:填空题
 反应类型加聚反应
反应类型加聚反应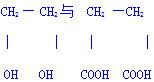 的聚合反应n HOCH2CH2OH+n HOOCCH2CH2COOH
的聚合反应n HOCH2CH2OH+n HOOCCH2CH2COOH 
 +(2n-1)H2O反应类型缩聚反应
+(2n-1)H2O反应类型缩聚反应 反应类型取代反应
反应类型取代反应查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 根据图填空:
根据图填空:查看答案和解析>>
科目: 来源: 题型:解答题
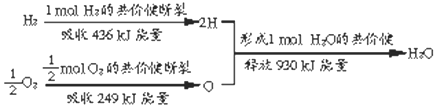
查看答案和解析>>
科目: 来源: 题型:解答题
 依据事实,写出下列反应的热化学方程式.
依据事实,写出下列反应的热化学方程式.| O═O | H-H | H-O(g) | |
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com